關于本書
近日,由清華大學藥學院楊悅研究員主編,清華大學法學院王晨光教授作序,中國醫(yī)藥科技出版社出版的《非處方藥監(jiān)管科學》正式與讀者見面。
該書是清華大學藥學院藥品監(jiān)管科學研究團隊的一項基于全球視野的非處方藥監(jiān)管的系統(tǒng)研究成果,也是非處方藥研發(fā)創(chuàng)新與監(jiān)管實踐經驗的總結。

Q1
為什么出版非處方藥監(jiān)管科學?
非處方藥的監(jiān)管科學是一項具有專屬性的議題和研究領域。
藥品監(jiān)管機構對于非處方藥的安全性、有效性、質量的評估,必須基于其中的活性成分或者配方長期上市經驗證據或者數據,已經確認有效性,而且具有安全性相對更高的特點,因此在藥品注冊管理中對非處方藥適宜性、便利性、個性化監(jiān)管要求給予充分的監(jiān)管靈活性考慮,為非處方藥的創(chuàng)新留下應有的空間。
本書的出版恰逢新修訂的《藥品注冊管理辦法》(2020年版)建立非處方藥直接上市路徑之際,也正當《處方藥與非處方藥分類管理辦法》修訂之時,希望本書的出版能夠為監(jiān)管機構、行業(yè)和企業(yè)提供一些非處方藥研發(fā)和監(jiān)管的新思維、新思路,為非處方藥監(jiān)管制度、路徑和程序的優(yōu)化提供有益的幫助!
Q2
本書適合哪些讀者閱讀?
本書適合于從事非處方藥研發(fā)和注冊、監(jiān)管,以及從事科研和教學的人員閱讀。
由于非處方藥注冊與處方藥有共同程序,本書中對藥品注冊分類和程序的內容也適用于處方藥研發(fā)注冊,但是同時結合了對非處方藥的特殊要求。本書中區(qū)別于處方藥注冊的非處方藥專屬性內容是核心關鍵。閱讀本書能夠理解非處方藥與處方藥注冊管理的共性,以及非處方藥注冊及管理的特殊性。
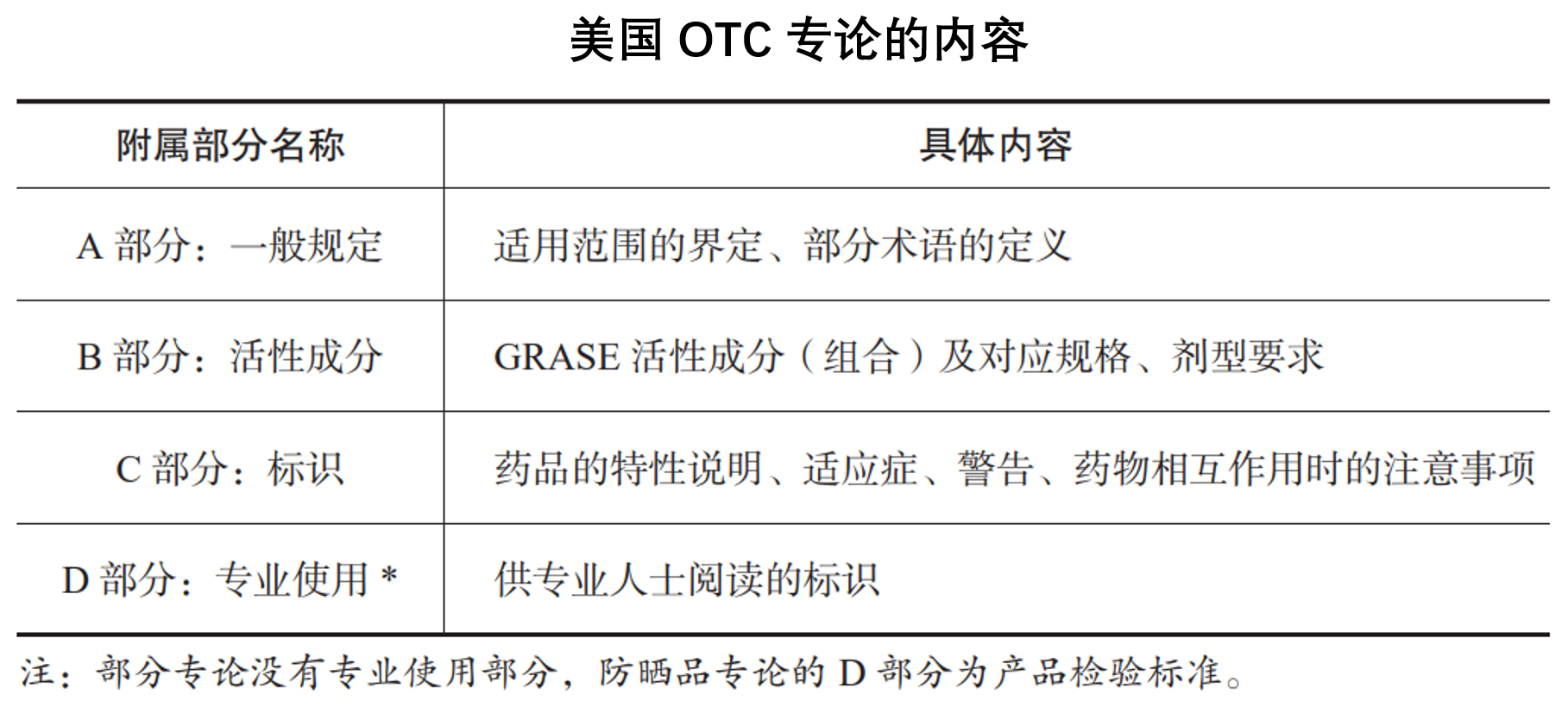

書中有關監(jiān)管的新方法是非處方藥的人為因素評價方法,該方法是不同于處方藥評價的獨特方法。非處方藥評價是在藥品長期使用的安全性、有效性較為確定的基礎上,研究藥物作為非處方藥使用的條件和說明書要求,特別注重對于說明書的理解力研究和個人使用研究等人為因素的評價,以確保在不依賴專業(yè)診療的情況下,患者仍可合理、安全使用非處方藥。
Q4
非處方藥監(jiān)管是國際監(jiān)管議題嗎?
是的,早在1970年,世界專有藥品制造商協會聯合會更名為世界自我藥療產業(yè)協會(WSMI),倡導將藥品分為處方藥和非處方藥兩類。1981 年,世界醫(yī)學會在“患者權利宣言”中強調自我健康護理的責任。1998 年,WSMI 和國際藥物聯合會(FIP)強調藥師在自我藥療中的作用。1998年,WHO將自我藥療定義為“個人選擇和使用藥物(包括草藥和傳統(tǒng)產品)治療自我識別的疾病或癥狀。自我藥療是自我健康護理的一個要素”。1999年,FIP和WSMI將自我藥療定義為患者自行使用非處方藥,并共同發(fā)布了倡導“負責任的自我藥療”(responsible self-medication)的聯合聲明。2000 年,WHO 發(fā)布了《用于自我藥療的藥品監(jiān)管評估指南》,向發(fā)展中國家建議實施處方藥與非處方藥分類管理模式。

圖1 國際非處方藥監(jiān)管歷程
非處方藥監(jiān)管是一個國際化的議題,也是WHO自我藥療健康倡議和監(jiān)管指南的核心議題之一。無論是發(fā)達國家,還是發(fā)展中國家等都非常重視處方藥與非處方藥的分類管理工作,為非處方藥建立了區(qū)別于處方藥的獨立監(jiān)管路徑、程序和要求。為了給自我藥療提供更多的非處方藥選擇,部分國家為非處方藥建立單獨的專論或者標識標準,基于這類產品風險較低的監(jiān)管考慮簡化注冊要求,優(yōu)化轉化程序,促進處方藥非處方藥創(chuàng)新發(fā)展。對于非處方藥的監(jiān)管,除了必須具備安全性和有效性要求之外,更加注重滿足不同人群的用藥需求,在用藥適宜性、便利性、個性化方面允許進行創(chuàng)新性的設計,更適合兒童、老年人以及有特殊需求的患者的自我診斷和自我用藥選用。
Q5
讀者如何閱讀?會有哪些獲益?
《非處方藥監(jiān)管科學》一書可以作為非處方藥研發(fā)和國際注冊的工具書,也可以作為監(jiān)管科學研究和政策制定的參考書。
可以有以下獲益:
第一,可以同時了解6個國家的非處方藥注冊路徑。由于除中國,日本以外的其他4個國家開辟了非處方藥備案或者登記路徑,相對于處方藥的前置性上市審批,上市程序主要依賴企業(yè)的質量承諾。處方藥與非處方藥的上市后檢查要求基本相同。非處方藥上市更多地依賴市場競爭,建立品牌聲譽。閱讀本書可以為面向國際的非處方藥研發(fā)上市拓寬視野。
第二,建立非處方藥上市的路徑思維。按照新藥、改良新、仿制藥、上市基礎良好的藥品(基于活性成分上市經驗)等分類,不同國家建立了不同的注冊路徑。在創(chuàng)改仿的注冊路徑之外,還建立了標準路徑或者專論注冊路徑,可以簡化注冊,但額外增加了人為因素影響評價等要求(理解力、個人使用研究等)。
第三,理解監(jiān)管機構的監(jiān)管考量,思考如何提高非處方藥監(jiān)管效率。在監(jiān)管資源有限的情況下,建立以風險為基礎的思維方式,在處方藥上市和使用經驗的基礎上,遴選或者轉化出某些有效性已經得到證實,安全性相對更好,無需醫(yī)生處方或者輔助就可以自行購買使用的活性成分。對于非處方藥的監(jiān)管,除了必須滿足安全性和有效性的基本要求之外,還注重滿足不同人群的用藥需求,在用藥適宜性、便利性、個性化方面允許進行創(chuàng)新性的設計,更加適合兒童、老年人以及有特殊需求的患者的自我診斷和藥療。企業(yè)可以以專論或者標準中納入的活性成分及其組合為基礎開發(fā)新的非處方藥上市。
第四,加深對非處方藥研發(fā)創(chuàng)新的理解。非處方藥絕大部分是老藥,行業(yè)中有某些偏見,認為非處方藥沒有創(chuàng)新。事實上,非處方藥的創(chuàng)新偏重于自我藥療適宜性、方便性和滿足個性化需求的創(chuàng)新。
Q6
書中有數據和案例嗎?
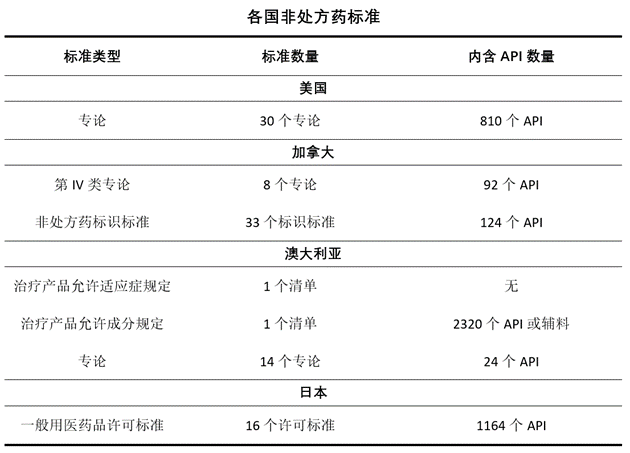
書中包含了中國等6個國家的非處方藥專論或者標準的內容分析,并對專論或者標準中的API數量進行了統(tǒng)計。
為了直觀地說明非處方藥的創(chuàng)新性。本書第十章中給出了17個非處方藥創(chuàng)新的案例,說明如何進行適合消費者自我藥療的非處方藥創(chuàng)新,使讀者理解,非處方藥研發(fā)創(chuàng)新也是具有臨床價值的。
Q7
閱讀本書能夠發(fā)現各國的非處方藥監(jiān)管差異嗎?
本書第八章對各國非處方藥監(jiān)管的涵義、組織架構、直接上市路徑、處方藥轉換非處方藥路徑、相關獨占權、上市后不良反應監(jiān)測、生產許可與檢查、經營監(jiān)管、廣告管理以及標識管理這十個方面進行了比較,并深入分析了存在差異的原因。本書并非簡單的法規(guī)羅列,是對各國非處方藥監(jiān)管科學現象和規(guī)律的深入研究。