2021年8月20日,清華大學藥學院饒燏團隊在《Cell Research》雜志上發(fā)表了題為“Merging PROTAC and molecular glue for degrading BTK and GSPT1 proteins concurrently”的研究論文,該工作報道了一類新型的雙機制降解劑,該降解劑既能夠以PROTAC方式靶向BTK,同時也以分子膠的方式降解GSPT1,與單靶降解劑或抑制劑相比,這種雙機制降解劑實現(xiàn)了更高效的DLBCL和AML腫瘤細胞增殖抑制效果,為DLBCL和AML治療提供新型治療方案。

靶向蛋白降解是以泛素-蛋白酶體系統(tǒng)為基礎,用小分子降解劑誘導靶蛋白降解的一種技術,其中最主要的兩種降解機制包括PROTAC和分子膠。PROTAC分子由三部分組成,此種組裝方式形成的嵌合體可將靶蛋白錨定到E3泛素連接酶進而誘導其泛素化降解。與PROTAC類似,分子膠是單一的小分子片段,分子量較小,它通過誘導靶蛋白與E3泛素連接酶之間形成較為緊密的蛋白-蛋白相互作用來實現(xiàn)泛素化降解。
近幾年兩種蛋白降解技術發(fā)展迅速,但也顯露出各自的優(yōu)缺點,例如PROTAC適于理性設計,但由于分子量偏大,導致成藥性不足。分子膠分子量小,成藥性好,且能降解難成藥靶點,可以彌補PROTAC的不足,但由于需要在兩個蛋白之間誘導形成一個結合口袋,設計上具有非常大的難度。而如何平衡二者的優(yōu)劣之處使靶向降解技術得到進一步發(fā)展是一個非常值得思考的問題,為打破現(xiàn)有技術的桎梏,作者在此工作中首次提出了將PROTAC分子與分子膠相融合的概念,為靶向蛋白降解開拓了一條新的道路。
作者在之前的工作中實現(xiàn)了BTK野生型和突變型蛋白的高效降解,解決了臨床耐藥問題,但另一挑戰(zhàn)出現(xiàn)了,目前不論是BTK抑制劑還是PROTAC分子,對難治性的DLBCL及AML很難達到較好的治療效果,而為了突破這一難題,作者想到可利用另一靶點的同時降解來實現(xiàn),GSPT1是翻譯終止因子,協(xié)調完成體內蛋白的翻譯過程,而GSPT1的下調可使蛋白表達異常,進而抑制多種腫瘤細胞的增殖和生存。因此作者希望利用雙機制降解劑將GSPT1的降解引入到靶向BTK的PROTAC分子中,進而打破靶向BTK分子在淋巴瘤應用中的壁壘。
如何將PROTAC與molecular glue兩種降解機制相融合是這篇工作中作者要解決的核心技術問題。因此基于此前開發(fā)的靶向BTK的PROTACs及已有針對GSPT1的分子膠的研究,作者開發(fā)了一系列雙靶雙機制降解劑并證明了這類降解劑分別以PROTAC和分子膠的方式降解BTK和GSPT1,首次實現(xiàn)了PROTAC和分子膠的理性結合和設計。并且與單靶抑制劑ibrutinib或降解劑L18I相比,作者所提出的雙機制降解劑在多種DLBCL及AML細胞上均具有更高效的增殖抑制活性,為臨床治療提供了新的方案,這也是該工作開發(fā)新型降解劑的應用價值所在。
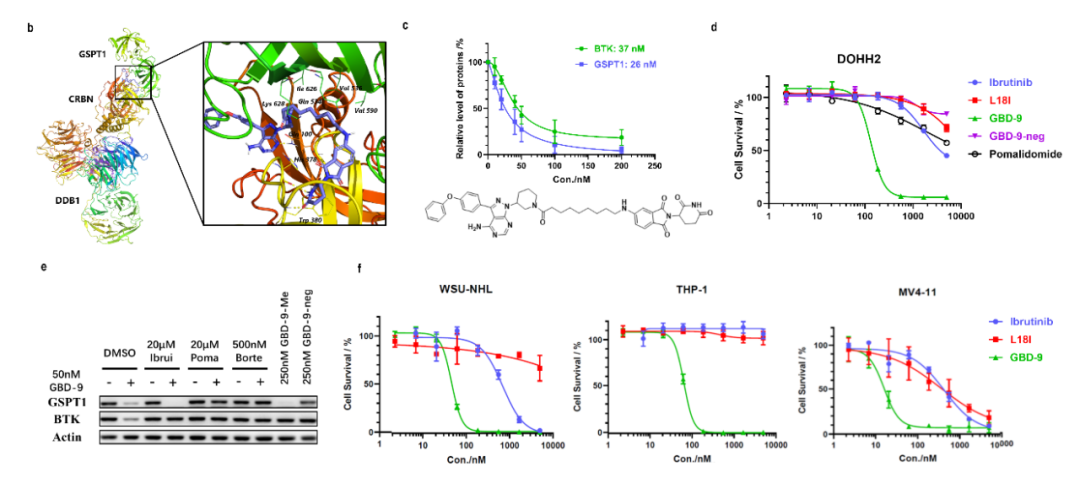
綜上,作者根據(jù)PROTAC和分子膠的特點首次設計合成了一系列雙靶、雙機制的降解劑,這類新型降解劑既保留了降解BTK的PROTAC活性,又兼具降解GSPT1的分子膠特點,以PROTAC的思路設計合成雙機制降解劑解決了分子膠設計難度高的問題,而作為分子膠降解GSPT1也補充了PROTAC在生物活性上的不足,對難治性腫瘤的臨床治療具有重要意義。因此,作者所致力于的雙機制降解劑開發(fā)為靶向降解技術的發(fā)展打開了新的大門。
饒燏團隊長期從事蛋白質靶向降解技術的開發(fā)工作,致力于發(fā)展新型降解技術及其應用,已取得了系列研究成果:實現(xiàn)難成藥靶點的藥物開發(fā),設計合成全球首例選擇性CDK2降解劑,實現(xiàn)AML高效且低毒的分化治療(Nature Chemical Biology 2021);構建高效的BTK降解劑,解決臨床中出現(xiàn)的Ibrutinib耐藥問題(Cell Research 2018;Leukemia 2019);構建PROTACs系統(tǒng)性敲除模型,快速可逆實現(xiàn)動物體內蛋白敲除(Cell Discovery 2019);構建PARP1降解劑(Chemical Communications 2019);構建新型CDK4/6降解劑,有效抑制腫瘤增殖(Journal of Medicinal Chemistry 2019);構建HDAC6降解劑,實現(xiàn)普適性的HDAC6的選擇性降解(Protein & Cell 2019;Chemical Communications 2019);構建FAK高效降解劑,抑制腫瘤的快速遷移(ACS Medicinal Chemistry Letters 2019)。此次研究也是該團隊拓展新型靶向蛋白降解技術研究的進一步延伸。
清華大學博士生楊子默、博士后孫永匯為該工作共同第一作者,清華大學饒燏教授為通訊作者。該研究得到了清華大學吳畏教授、鄧海騰教授、李海濤教授、劉萬里教授的大力幫助。該研究得到了國家自然科學基金、國家重大科技專項“重大新藥開發(fā)”和國家重點研發(fā)計劃的大力支持。
原文鏈接:https://www.nature.com/articles/s41422-021-00533-6

