最新科研速遞

2023年5月9日,清華大學(xué)藥學(xué)院饒燏團(tuán)隊(duì)、清華大學(xué)醫(yī)學(xué)院李海濤團(tuán)隊(duì)與清華大學(xué)生命學(xué)院李丕龍團(tuán)隊(duì)聯(lián)合,在Cell Discovery雜志在線發(fā)表了題為“BRD4-targeting PROTAC as a unique tool to study biomolecular condensates”的研究性論文。在這項(xiàng)研究中,作者利用PROTAC高效、快速、可逆、動(dòng)態(tài)降解靶蛋白的特性,通過(guò)降解BRD4探究其相關(guān)生物大分子凝聚物形成特征,聯(lián)用免疫熒光染色和高通量測(cè)序?qū)ROTAC誘導(dǎo)的靶蛋白分相形態(tài)和功能的改變進(jìn)行監(jiān)測(cè),揭示該過(guò)程中BRD4與其他組分凝聚物的功能伴隨,這是PROTAC在LLPS研究中的首次運(yùn)用,為解決領(lǐng)域內(nèi)關(guān)鍵問(wèn)題提供了新方法和新見(jiàn)解。
研究背景
PROTAC (PROteolysis TArgeting Chimeras)技術(shù)是近年來(lái)蓬勃發(fā)展的新興蛋白質(zhì)降解策略。PROTAC的基本原理是使用雙功能小分子,通過(guò)泛素-蛋白酶體系統(tǒng)誘導(dǎo)靶蛋白的泛素化,進(jìn)而實(shí)現(xiàn)靶蛋白降解。自2019年第一個(gè)靶向雄激素受體PROTAC分子ARV-110進(jìn)入臨床研究以來(lái),PROTAC領(lǐng)域進(jìn)入快速發(fā)展期。
液液相分離 (liquid-liquid phase separation, LLPS)是生物大分子在真核細(xì)胞中聚集形成無(wú)膜細(xì)胞器的基礎(chǔ),也是細(xì)胞區(qū)域化的重要機(jī)制,展現(xiàn)了真核細(xì)胞對(duì)各種生理活動(dòng)的精準(zhǔn)、動(dòng)態(tài)的時(shí)空調(diào)控。當(dāng)前,如何建立相分離現(xiàn)象和生物學(xué)功能之間的關(guān)系是該領(lǐng)域內(nèi)的重要科學(xué)問(wèn)題。相分離對(duì)系統(tǒng)計(jì)量高度依賴(lài),各組分形成分相的臨界濃度尤為關(guān)鍵,因此需要高效、快速、動(dòng)態(tài)的擾動(dòng)技術(shù)的支持。此外,如何避免體外實(shí)驗(yàn)中出現(xiàn)假陽(yáng)性的可能、探究生理?xiàng)l件下的相分離狀態(tài)、剖析分相液滴中支架蛋白與乘客蛋白身份和功能的轉(zhuǎn)換及其內(nèi)在分子機(jī)制等問(wèn)題都迫切需要新技術(shù)和新方法的建立。現(xiàn)有技術(shù)手段如CRISPR-Cas9/RNA干擾(RNAi)等遺傳學(xué)工具在體內(nèi)直接研究相分離面臨很多挑戰(zhàn)。基因編輯技術(shù)對(duì)DNA修改具有不可逆的特點(diǎn),難以獲得編碼蛋白質(zhì)的中間狀態(tài)。RNAi技術(shù)由于起效時(shí)間長(zhǎng),在體內(nèi)快速動(dòng)態(tài)的相變化過(guò)程中,RNAi不足以作為一個(gè)強(qiáng)有力的研究工具。小分子抑制劑雖然能夠影響相分離的形成,但其多作用于底物結(jié)合位點(diǎn),而相分離常由蛋白質(zhì)其他的如骨架功能誘導(dǎo),會(huì)導(dǎo)致研究不夠充分,同時(shí)小分子抑制劑發(fā)揮其功能往往會(huì)導(dǎo)致目標(biāo)蛋白上調(diào)反饋,需要更高的作用劑量。相分離領(lǐng)域仍然缺乏在野生型細(xì)胞系上直接干擾LLPS的高效方法。
研究結(jié)果
首先,通過(guò)PROTAC、免疫熒光染色、定量計(jì)算等技術(shù)的聯(lián)用,研究者們建立了靶向細(xì)胞內(nèi)BRD4凝聚物的“PROTAC-target protein-LLPS”研究方法。研究者們使用100 nM的ZXH-3-26在HeLa細(xì)胞中測(cè)定內(nèi)源的BRD4降解動(dòng)力學(xué)。他們發(fā)現(xiàn),靶向BRD4的PROTAC分子(ZXH-3-26)能夠在低濃度、短時(shí)間內(nèi)快速降解BRD4及其凝聚物(圖1)。BRD4-PROTACs處理細(xì)胞30分鐘后即可觀察到BRD4蛋白水平顯著降低,4小時(shí)后BRD4蛋白完全降解,同時(shí)BRD4凝聚物數(shù)量也急劇減少。這說(shuō)明PROTAC能夠作為一個(gè)快速擾動(dòng)凝聚物組分的工具。
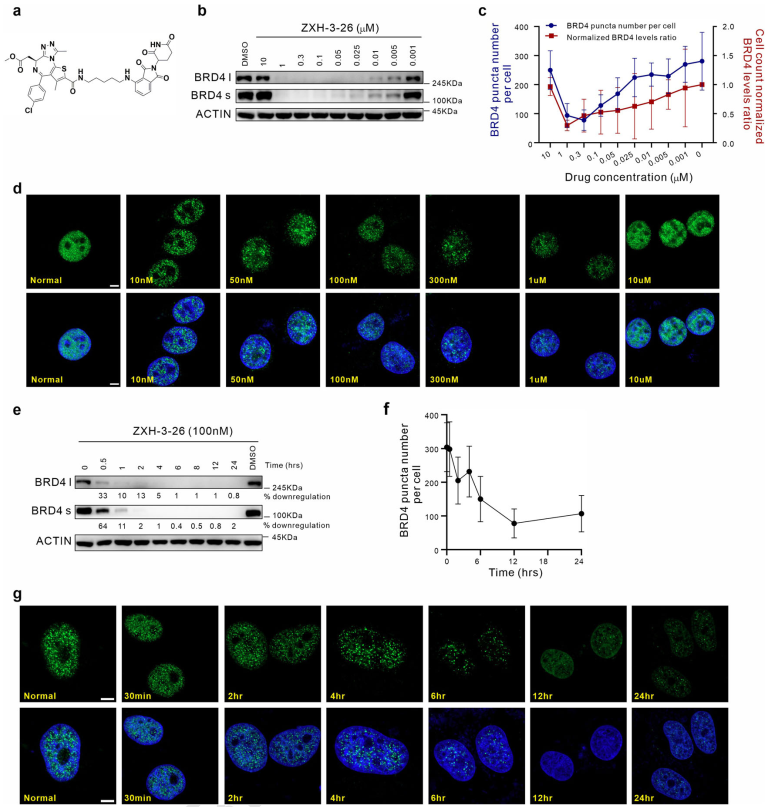
圖1. “PROTAC-target protein-LLPS”研究方法的建立
隨后,研究者們利用PROTAC的可逆性進(jìn)一步探究該技術(shù)運(yùn)用于LLPS研究的潛力。有趣的是,他們通過(guò)Wash-out實(shí)驗(yàn)發(fā)現(xiàn),去除BRD4-PROTACs后24 小時(shí),內(nèi)源的BRD4凝聚物數(shù)量已幾乎恢復(fù)到原始水平,而此時(shí)BRD4的蛋白水平才剛剛開(kāi)始出現(xiàn)恢復(fù)跡象(圖2)。即BRD4相關(guān)凝聚物的恢復(fù)可能優(yōu)先于BRD4蛋白水平的恢復(fù),這是PROTAC應(yīng)用于LLPS研究首次發(fā)現(xiàn)的現(xiàn)象。
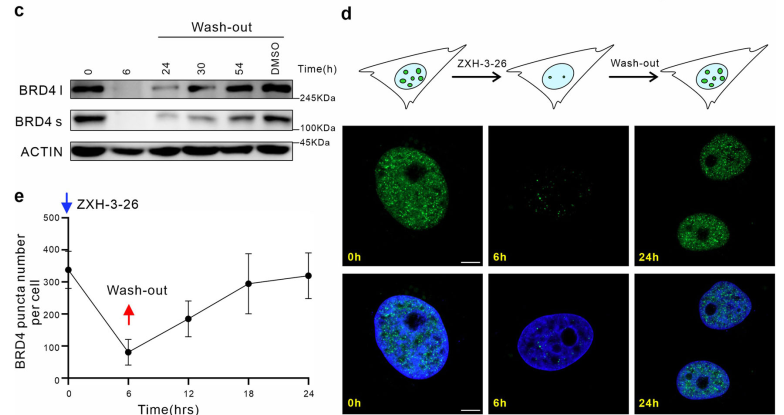
圖2. BRD4-PROTACs的可逆性助力LLPS研究
針對(duì)以上有趣的現(xiàn)象,研究者們進(jìn)一步開(kāi)展多組學(xué)分析闡釋其可能的生理功能意義。通過(guò)RNA-seq和Cut&Tag-seq探討對(duì)照組、BRD4-PROTACs處理后6小時(shí)、wash-out 18小時(shí)、wash-out 42小時(shí)的基因表達(dá)譜,以及BRD4在TSS區(qū)、enhancer區(qū)和super-enhancer區(qū)的定位變化。數(shù)據(jù)顯示, wash-out 42小時(shí)組的基因表達(dá)情況已經(jīng)恢復(fù)到與對(duì)照組接近。更令人意外的是,隨著降解劑的去除,BRD4在短時(shí)間內(nèi)迅速恢復(fù)并更偏好占據(jù)在super-enhancer區(qū),尤其是一些關(guān)鍵癌基因和細(xì)胞周期基因的super-enhancer區(qū) (圖3)。這一結(jié)果說(shuō)明PROTAC可以成為研究生物大分子凝聚物的生理病理功能的一種強(qiáng)有力工具,它的降解快速且可逆是其作為L(zhǎng)LPS研究工具的關(guān)鍵優(yōu)勢(shì)。


圖3. BRD4-PROTAC降解及Wash-out實(shí)驗(yàn)引起細(xì)胞基因組和染色質(zhì)狀態(tài)變化
生物大分子凝聚物中各組分的多價(jià)態(tài)相互作用是LLPS的基礎(chǔ),剖析其中關(guān)鍵組分蛋白之間的物理及功能交互是LLPS領(lǐng)域內(nèi)的關(guān)鍵問(wèn)題。于是研究者們基于BRD4-PROTACs探討B(tài)RD4相關(guān)凝聚物中其他重要組分(MED1/CYCT1/p300)的分相變化。研究者發(fā)現(xiàn),在BRD4-PROTACs的作用下,內(nèi)源的MED1和CYCT1凝聚物在6小時(shí)內(nèi)顯著減少, 12 小時(shí)又恢復(fù)到與對(duì)照組幾近相同的水平。而p300作為BRD4的上游分子,其凝聚物不受干擾(圖4)。另外,他們首次發(fā)現(xiàn)隨著B(niǎo)RD4降解,BRD3在MED1和CYCT1凝聚物的恢復(fù)過(guò)程中發(fā)揮了代償功能。靶向BRD4的PROTACs不僅為研究BRD4相分離提供了一種新的有效工具,而且為剖析BRD4相分離的分子機(jī)制和動(dòng)力學(xué)提供了一種新的策略。
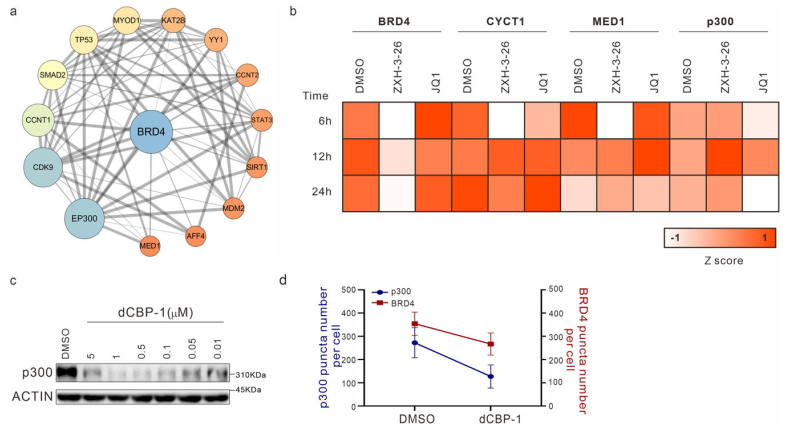

圖4. 通過(guò)BRD4-PROTACs探究MED1/CYCT1/p300/BRD3在BRD4相分離中的關(guān)鍵功能
研究意義
總之,在該工作中,研究者首次建立了“PROTAC-target protein-LLPS”的研究方法,以期從多維度探究LLPS相關(guān)的內(nèi)源蛋白-蛋白相互作用、蛋白時(shí)空動(dòng)態(tài)調(diào)控的精密機(jī)制。在LLPS研究中,基于PROTAC的研究方法快速、高效、可逆,優(yōu)于傳統(tǒng)遺傳學(xué)工具對(duì)靶基因的擾動(dòng);同時(shí),相較于常用解聚凝聚體的小分子(如1,6-己二醇),PROTAC也更具有特異性和靶向性。另外,將此方法與多組學(xué)手段聯(lián)合分析,不僅能夠探究凝聚物中各組分之間的互作和功能伴隨,而且將為相分離與生物功能之間建立因果關(guān)系提供可能。值得一提的是,PROTAC技術(shù)被譽(yù)為助力小分子藥物開(kāi)發(fā)進(jìn)入“新黃金時(shí)代”的技術(shù), PROTAC有望在相分離異常導(dǎo)致的疾病治療中發(fā)揮其重要作用。

圖5. BRD4-PROTACs工作模型示意圖
饒燏團(tuán)隊(duì)長(zhǎng)期從事蛋白質(zhì)靶向降解技術(shù)的開(kāi)發(fā)工作,致力于發(fā)展新型降解技術(shù)及其應(yīng)用,已取得了系列研究成果:提出了 PROTAC 和分子膠協(xié)同應(yīng)用的模式。首次設(shè)計(jì)合成了新型雙靶、雙機(jī)制的降解劑,為靶向降解技術(shù)的發(fā)展提出了新的思路(Cell Research 2021);實(shí)現(xiàn)難成藥靶點(diǎn)的藥物開(kāi)發(fā),設(shè)計(jì)合成全球首例選擇性CDK2降解劑,實(shí)現(xiàn)AML高效且低毒的分化治療(Nature Chemical Biology 2021);構(gòu)建高效的BTK降解劑,解決臨床中出現(xiàn)的Ibrutinib耐藥問(wèn)題(Cell Research 2018;Leukemia 2019);構(gòu)建PROTACs系統(tǒng)性敲除模型,快速可逆實(shí)現(xiàn)動(dòng)物體內(nèi)蛋白敲除(Cell Discovery 2019);構(gòu)建新型CDK4/6降解劑,有效抑制腫瘤增殖(Journal of Medicinal Chemistry 2019);此次研究也是該團(tuán)隊(duì)拓展新型靶向蛋白降解技術(shù)與生物學(xué)新興前沿-相分離領(lǐng)域的交叉探索。
清華大學(xué)藥學(xué)院饒燏課題組2020級(jí)博士生施奕(CLS項(xiàng)目)、醫(yī)學(xué)院李海濤課題組2020級(jí)博士生廖源(PTN項(xiàng)目)為該論文共同第一作者,清華大學(xué)藥學(xué)院博士生劉乾隆,博士生倪智豪以及醫(yī)學(xué)院博士生張真真參與了該工作,清華大學(xué)李丕龍教授、李海濤教授和饒燏教授為共同通訊作者。清華大學(xué)醫(yī)學(xué)院師明磊研究員為本論文提供了寶貴建議和指導(dǎo)。該研究得到了清華大學(xué)吳畏教授、鄧海騰教授和曾堅(jiān)陽(yáng)教授的幫助,并得到了清華大學(xué)細(xì)胞影像中心以及尼康影像中心的技術(shù)支持。該研究得到了中國(guó)國(guó)家自然科學(xué)基金和國(guó)家重點(diǎn)研發(fā)計(jì)劃的大力支持。
論文鏈接:https://www.nature.com/articles/s41421-023-00544-0

