蛋白質(zhì)藥物因其高特異性和在調(diào)節(jié)生物過程中的關(guān)鍵作用,已成為治療多種疾病的重要手段。然而,在系統(tǒng)性給藥時(shí),蛋白質(zhì)藥物常因作用于非靶組織而產(chǎn)生副作用1。因此,開發(fā)能夠精準(zhǔn)靶向特定器官或組織的納米載體,對(duì)于提高蛋白質(zhì)藥物的療效和安全性至關(guān)重要。
納米載體在體內(nèi)會(huì)面臨多種生物屏障,并與多種生物分子相互作用2。其尺寸、電荷、形狀、表面化學(xué)性質(zhì)、剛性以及化學(xué)組成等因素均會(huì)影響其體內(nèi)分布、細(xì)胞攝取和治療效果。由于納米載體與生物體之間的相互作用極為復(fù)雜,開發(fā)針對(duì)特定器官的靶向載體仍面臨巨大挑戰(zhàn)。此外,傳統(tǒng)的納米載體篩選方法效率低下,難以快速找到理想的靶向載體。
2025年1月21日,清華大學(xué)藥學(xué)院杜娟娟團(tuán)隊(duì)在《Nature Communications》雜志發(fā)表了一篇題為“Barcoded screening identifies nanocarriers for protein delivery to kidney”的研究論文。研究者利用DNA條碼高通量篩選技術(shù)3,成功開發(fā)出一種能夠高效將蛋白質(zhì)遞送至腎臟的納米載體。通過將獨(dú)特的DNA序列嵌入納米載體,研究人員可以在體內(nèi)同時(shí)篩選多種納米載體,從而大大提高了篩選效率。這一成果為腎臟疾病的治療提供了新的思路和工具。
研究團(tuán)隊(duì)構(gòu)建了一個(gè)包含143種不同表面性質(zhì)的納米膠囊?guī)欤⑼ㄟ^原位自由基聚合反應(yīng)將多種單體組合成具有獨(dú)特表面特性的納米膠囊(圖1)。利用DNA條碼技術(shù),他們將生物素標(biāo)記的DNA條碼與納米膠囊結(jié)合,并通過光可切割連接子實(shí)現(xiàn)DNA條碼的高效提取和富集。在體外實(shí)驗(yàn)中,研究人員發(fā)現(xiàn)某些特定組成的納米膠囊對(duì)細(xì)胞具有高效的結(jié)合能力。進(jìn)一步的在小鼠體內(nèi)篩選實(shí)驗(yàn)中,研究者成功篩選出能夠特異性富集在腎臟、肝臟和肺部的納米膠囊。其中,腎臟富集的納米膠囊(nSA-Z20和nSA-Z40)表現(xiàn)出顯著的靶向能力,且實(shí)驗(yàn)表明納米膠囊的聚合物組成是決定腎臟富集的關(guān)鍵因素,而非納米膠囊的尺寸或表面電荷。
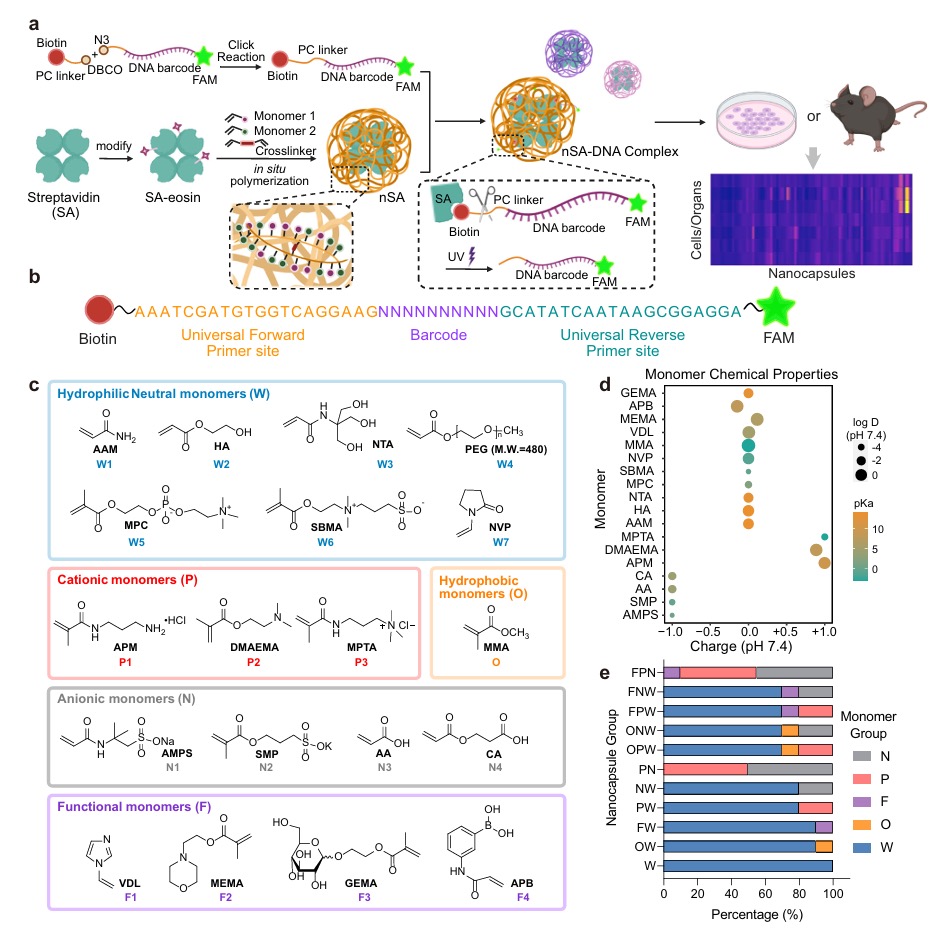
圖1 DNA條碼以及納米膠囊?guī)斓脑O(shè)計(jì)
研究團(tuán)隊(duì)還利用這些腎臟靶向納米膠囊遞送過氧化氫酶(Catalase),以緩解順鉑誘導(dǎo)的急性腎損傷。實(shí)驗(yàn)結(jié)果表明,經(jīng)過納米膠囊遞送的過氧化氫酶能夠顯著減輕腎臟損傷,降低血清尿素氮和肌酐水平,并減少腎臟中的活性氧(ROS)生成(圖2)。

圖2. 腎靶向納米膠囊顯著緩解順鉑誘導(dǎo)的急性腎損傷
這項(xiàng)研究不僅提供了一種高效的納米載體篩選方法,還展示了通過表面工程調(diào)控納米載體分布的潛力。借助DNA條碼技術(shù),研究人員能夠在復(fù)雜的生物環(huán)境中快速找到理想的納米載體,為蛋白質(zhì)藥物的精準(zhǔn)遞送提供了新的策略。未來,該團(tuán)隊(duì)還將深入研究納米載體在體內(nèi)的蛋白冠組成,以更好地理解其靶向機(jī)制。總之,這項(xiàng)研究為腎臟疾病的治療提供了新的希望,也為納米醫(yī)學(xué)領(lǐng)域的發(fā)展注入了新的活力。納米載體的精準(zhǔn)遞送技術(shù)有望在更多疾病的治療中發(fā)揮重要作用。
清華大學(xué)藥學(xué)院杜娟娟副教授為本論文的通訊作者,藥學(xué)院2018級(jí)已畢業(yè)博士生王璐瑤(現(xiàn)為西湖大學(xué)工學(xué)院博士后)、2022級(jí)博士生周雯為論文的共同第一作者。陳航(現(xiàn)北京大學(xué)醫(yī)學(xué)部博士后)、賈向前(現(xiàn)黑龍江大學(xué)生命科學(xué)院副教授)、鄭培源(2020級(jí)博士生)等也為該研究作出了重要貢獻(xiàn)。華南理工大學(xué)杜步婕教授、清華大學(xué)藥學(xué)院田博學(xué)副教授為該研究提供了極大幫助。該研究得到了國家重點(diǎn)研發(fā)計(jì)劃(2017YFA0207900)和清華-北京生命科學(xué)聯(lián)合中心(CLS)項(xiàng)目的資助。
參考文獻(xiàn)
1. Su, H., Rong, G., Li, L. & Cheng, Y. Subcellular targeting strategies for protein and peptide delivery. Adv. Drug. Deliver. Rev. 212, https://doi.org/10.1016/j.addr.2024.115387 (2024).
2. Poon, W., Kingston, B. R., Ouyang, B., Ngo, W. & Chan, W. C. W. A framework for designing delivery systems. Nat. Nanotechnol. 15, 819–829 (2020).
3. Dahlman, J. E. et al. Barcoded nanoparticles for high throughput in vivo discovery of targeted therapeutics. Proc.Natl.Acad.Sci.USA 114,2060–2065 (2017).
論文鏈接:https://www.nature.com/articles/s41467-025-56257-3

