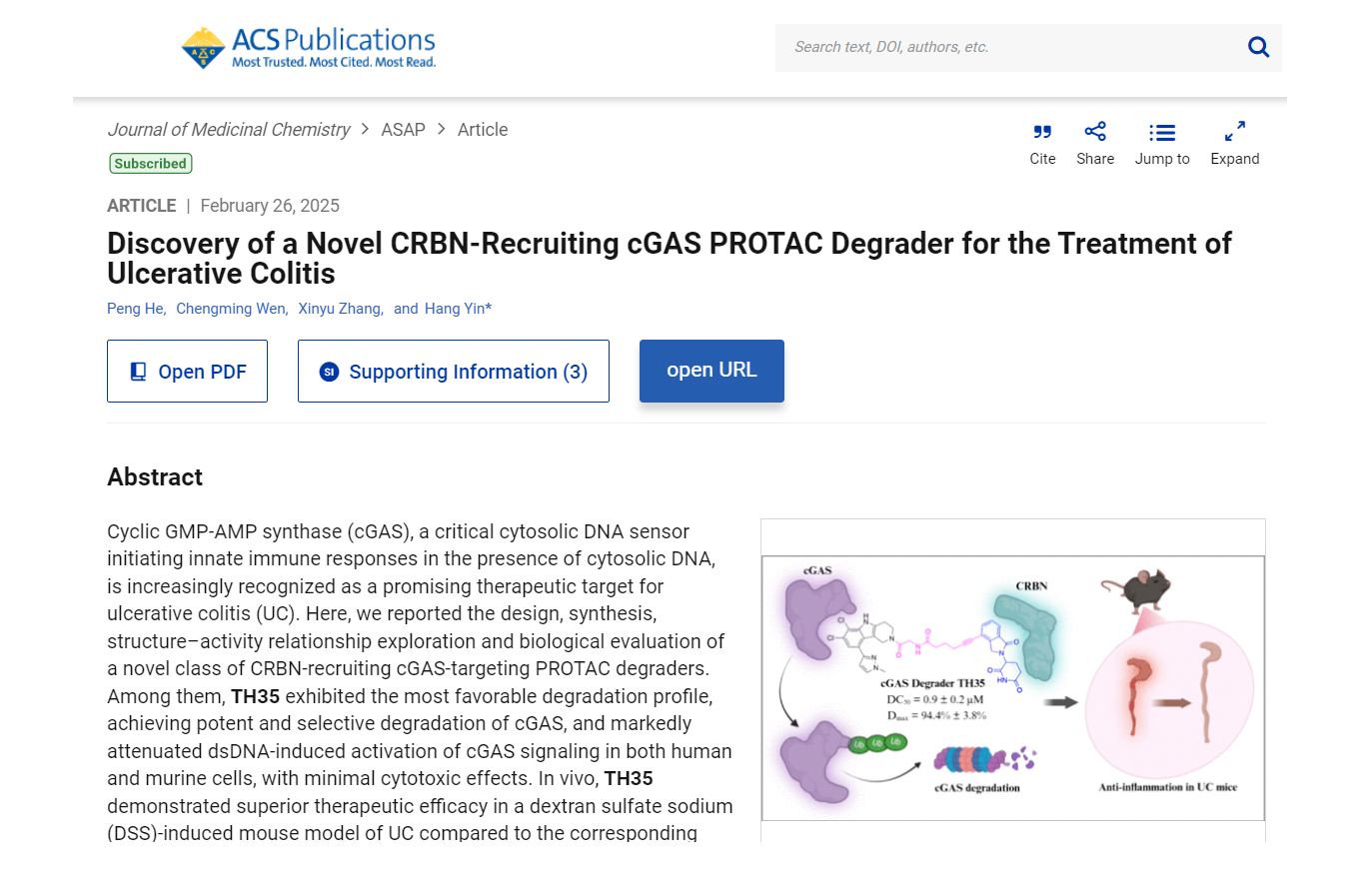
2025年2月26日,清華大學(xué)藥學(xué)院尹航課題組在美國化學(xué)會(huì)Journal of Medicinal Chemistry上發(fā)表了題為 “Discovery of a Novel CRBN-Recruiting cGAS PROTAC Degrader for the Treatment of Ulcerative Colitis” 的研究性論文。該研究報(bào)道了首個(gè)CRBN介導(dǎo)的cGAS降解劑TH35,并探究其在潰瘍性結(jié)腸炎(UC)模型中的治療潛力,證明了cGAS 靶向降解策略在安全性和有效性上相較于抑制劑的顯著性優(yōu)勢。本文第一作者何朋博士2025年1月博士后出站,現(xiàn)就職于湖南大學(xué)生命醫(yī)學(xué)前沿交叉研究院,擔(dān)任副教授、博士生導(dǎo)師,開展獨(dú)立研究工作。
環(huán)磷酸鳥苷-腺苷合成酶(Cyclic GMP-AMP Synthase,cGAS)是先天免疫系統(tǒng)中識(shí)別細(xì)胞質(zhì)DNA的關(guān)鍵傳感器,主要通過識(shí)別細(xì)胞內(nèi)的雙鏈DNA(dsDNA)激活免疫反應(yīng)。除了防御病原外,cGAS通路還參與細(xì)胞凋亡、衰老和自噬等生理過程。然而,cGAS的過度激活會(huì)引發(fā)慢性炎癥反應(yīng),導(dǎo)致自身免疫性疾病的發(fā)生和發(fā)展,如在潰瘍性結(jié)腸炎(UC)中發(fā)揮重要作用。UC病程長,易復(fù)發(fā),病因復(fù)雜,被世界衛(wèi)生組織列為現(xiàn)代難治病之一,且目前缺乏特異性治療手段。近年來,大量研究表明cGAS在UC中高度活化,抑制其激活能促進(jìn)UC的緩解和恢復(fù),也有研究表明通過基因編輯技術(shù)體內(nèi)敲低cGAS可顯著抑制UC的進(jìn)程。因此,cGAS可作為治療潰瘍性結(jié)腸炎的潛在新興靶點(diǎn)。但是,cGAS抑制劑的研究目前仍然處于早期摸索階段,現(xiàn)有cGAS抑制劑存在脫靶,毒性大,體內(nèi)外活性不佳或理化性質(zhì)較差等限制其進(jìn)一步發(fā)展與應(yīng)用的問題,亟需通過新的藥物設(shè)計(jì)策略來發(fā)現(xiàn)更優(yōu)活性的分子來突破cGAS抑制劑的瓶頸。
近年來,以蛋白降解靶向嵌合體(Proteolysis-Targeting Chimeras, PROTAC)技術(shù)為代表的靶蛋白降解技術(shù)在藥物開發(fā)領(lǐng)域占據(jù)越來越重要的地位,其不斷創(chuàng)新和發(fā)展的藥物設(shè)計(jì)模式給小分子藥物開發(fā)帶來了新的希望。然而,目前關(guān)于靶向cGAS 開發(fā)RPOTAC降解劑的研究尚未見報(bào)道。在此背景下,尹航課題組提出基于PROTAC技術(shù)開發(fā)首個(gè)cGAS降解劑,并探究其在UC小鼠模型中的抗炎活性與機(jī)制。
在cGAS PROTAC分子的設(shè)計(jì)過程中,尹航課題組選取了對(duì)人源和鼠源cGAS均具有高親和力的cGAS抑制劑G140作為靶蛋白配體,選擇了具有優(yōu)異理化性質(zhì)和藥代動(dòng)力學(xué)特征的CRBN配體(來那度胺,沙利度胺)作為E3泛素連接酶配體。隨后以cGAS與G108(與G140結(jié)構(gòu)相似的類比物)的復(fù)合物共晶結(jié)構(gòu)為參考,對(duì)G140與cGAS進(jìn)行分子對(duì)接分析并發(fā)現(xiàn)G140中的甲基吡唑環(huán)和羥基乙酰基團(tuán)與G108中的相應(yīng)基團(tuán)具有相似的空間布局,均暴露于溶劑區(qū),表明這些基團(tuán)可作為連接鏈附著的理想位點(diǎn)。隨后,他們引入了不同長度和化學(xué)類型的連接鏈,包括柔性基團(tuán)(如乙二醇(PEG)鏈、烷基鏈)和剛性基團(tuán)(如哌嗪環(huán)、哌啶環(huán)、炔基烷基鏈),并合成了系列PROTAC分子(TH1至TH42)。通過評(píng)估各分子的降解活性及其對(duì)cGAS通路的抑制效果,系統(tǒng)探究其構(gòu)效關(guān)系,最終確定具有最佳活性的候選分子TH35(見圖1)。
圖1.新型cGAS PROTAC降解劑的設(shè)計(jì)策略
研究發(fā)現(xiàn),TH35在THP-1和RAW 264.7細(xì)胞中以濃度依賴性方式有效降解cGAS,DC50值分別為0.9 ± 0.2 μM和4.6 ± 0.8 μM,最大降解率超過90%。質(zhì)譜分析顯示,TH35顯著降低cGAS蛋白水平,且在3,852個(gè)識(shí)別蛋白中,32個(gè)蛋白的表達(dá)顯著下調(diào),主要為干擾素刺激基因誘導(dǎo)的蛋白,表明TH35通過降解cGAS抑制I型干擾素反應(yīng)。回補(bǔ)實(shí)驗(yàn)結(jié)果顯示,cGAS抑制劑G140、CRBN配體來那度胺或蛋白酶體抑制劑MG132能夠顯著逆轉(zhuǎn) TH35 在 THP-1細(xì)胞中的cGAS降解效應(yīng),進(jìn)一步證明TH35通過CRBN依賴的泛素-蛋白酶體途徑誘導(dǎo)cGAS降解(見圖2)。
圖2. TH35的降解活性及降解機(jī)制的研究
cGAS作為細(xì)胞質(zhì)中的DNA傳感器,能夠識(shí)別細(xì)胞內(nèi)的雙鏈DNA(dsDNA),并激活下游的STING-TBK1-IRF3信號(hào)級(jí)聯(lián)反應(yīng),在自身免疫性疾病的發(fā)病機(jī)制中扮演著關(guān)鍵角色。因此,尹航課題組進(jìn)一步研究TH35是否能夠有效的選擇性抑制dsDNA誘導(dǎo)cGAS-STING通路激活。定量質(zhì)譜分析顯示,TH35顯著降低了HT-DNA刺激下THP-1細(xì)胞中的cGAMP生成。熒光素酶報(bào)告基因?qū)嶒?yàn)和Western blot分析進(jìn)一步證明,TH35以劑量依賴方式抑制HT-DNA刺激的cGAS信號(hào)傳導(dǎo)及其下游關(guān)鍵蛋白(如STING、TBK1和IRF3)的磷酸化。此外,TH35在TREX1敲除條件下依然能顯著抑制內(nèi)源性cGAS激活,且對(duì)由poly (I: C)和cGAMP刺激的IFNB表達(dá)沒有顯著影響,進(jìn)一步證明其較佳的特異性(見圖3)。
圖3. TH35選擇性抑制dsDNA誘導(dǎo)cGAS通路激活的研究
進(jìn)一步細(xì)胞毒性評(píng)價(jià)表明,TH35在高達(dá)60 μM的濃度下對(duì)多株免疫細(xì)胞未表現(xiàn)出顯著的細(xì)胞毒性。相比之下,作為陽性對(duì)照的G140在超過30 μM的濃度下顯著誘發(fā)細(xì)胞毒性。這些結(jié)果表明,TH35相較于cGAS抑制劑G140展現(xiàn)出更為有利的體外安全性特征,具有較低的脫靶毒性(見圖4)。
圖4. TH35與G140細(xì)胞毒性的評(píng)價(jià)
研究評(píng)估了TH35在DSS誘導(dǎo)的小鼠結(jié)直腸炎(UC)模型中的治療效果。實(shí)驗(yàn)結(jié)果顯示,TH35在20 mg/kg和50 mg/kg劑量下均顯著緩解了DSS引起的小鼠體重減輕,且治療效果優(yōu)于傳統(tǒng)藥物5-ASA和cGAS抑制劑G140。疾病活動(dòng)指數(shù)(DAI)評(píng)分顯示,TH35治療組的DAI得分顯著低于5-ASA和G140組,進(jìn)一步驗(yàn)證了其抗炎效果。此外,TH35治療顯著緩解了結(jié)腸萎縮和脾腫大現(xiàn)象,且組織學(xué)檢查顯示結(jié)腸組織病理學(xué)顯著改善,脾臟形態(tài)恢復(fù)接近正常,病理評(píng)分低于5-ASA和G140組。綜上,TH35在自身免疫疾病小鼠模型中相較于cGAS抑制劑G140具有更優(yōu)的抗炎活性(圖5)。
圖5. TH35體內(nèi)藥效評(píng)價(jià)
機(jī)制研究發(fā)現(xiàn),TH35在潰瘍性結(jié)腸炎(UC)小鼠模型中通過特異性降解cGAS,顯著抑制其下游信號(hào)通路,減少炎癥反應(yīng)。Western blot分析顯示,TH35治療劑量依賴性地降低了結(jié)腸中cGAS蛋白的表達(dá)水平。與5-ASA和G140相比,TH35對(duì)cGAS表達(dá)變化無顯著影響,顯示其在抗炎活性方面的不同作用機(jī)制。此外,TH35有效抑制了cGAS信號(hào)通路中下游關(guān)鍵蛋白(如STING、TBK1和IRF3)的磷酸化,且這種抑制作用呈現(xiàn)出明顯的劑量依賴性。RT-qPCR分析進(jìn)一步表明,TH35顯著降低了結(jié)腸中多種關(guān)鍵炎癥細(xì)胞因子的轉(zhuǎn)錄水平,包括Ifnb、Tnf-α和Il-6。ELISA方法檢測結(jié)果也顯示,TH35顯著降低了血清中TNF-α和IL-6的水平。此外,TH35顯著減少了結(jié)腸組織中中性粒細(xì)胞外陷阱(NETs)的形成,表明其在抑制NETs方面的作用優(yōu)于5-ASA和G140。綜上,TH35通過特異性降解cGAS,抑制其下游免疫應(yīng)答反應(yīng),減輕UC小鼠模型中的炎癥反應(yīng)。
圖6. TH35體內(nèi)抗炎機(jī)制研究
本研究成功設(shè)計(jì)并報(bào)道了首個(gè)CRBN介導(dǎo)的cGAS PROTAC降解劑,其在體內(nèi)外抗炎活性和安全性較cGAS抑制劑具有顯著性提升,為cGAS靶向降解治療自身免疫性疾病奠定了基礎(chǔ)。
本文通訊作者是清華大學(xué)藥學(xué)院教授尹航,共同第一作者是清華大學(xué)藥學(xué)院博士后何朋和溫成銘,何朋博士于2025年1月博士后出站,現(xiàn)就職于湖南大學(xué)生命醫(yī)學(xué)前沿交叉研究院,擔(dān)任副教授、博士生導(dǎo)師(目前正在組建實(shí)驗(yàn)團(tuán)隊(duì),請(qǐng)感興趣的同學(xué)多多關(guān)注,何朋課題組網(wǎng)址為:http://grzy.hnu.edu.cn/site/index/hepeng2 ),清華大學(xué)藥學(xué)院在讀博士張新宇也為本課題做出重要貢獻(xiàn)。清華大學(xué)藥學(xué)院藥學(xué)技術(shù)平臺(tái)中心的王衛(wèi)華等老師在藥代動(dòng)力學(xué)測試方面提供了幫助。本研究得到國家自然科學(xué)基金、北京市自然科學(xué)基金、北京市卓越青年科學(xué)家項(xiàng)目、中國博士后科學(xué)基金和國家資助博士后研究人員計(jì)劃的資助。
論文鏈接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.4c02774

