2025年6月6日,清華大學(xué)藥學(xué)院儲(chǔ)凌課題組在《Journal of the American Chemical Society》期刊發(fā)表了題為“Silicon-Rhodamine-Catalyzed Near-Infrared Light-Induced Photodecaging of Ortho-Nitrobenzyl Groups In Vitro and In Vivo”的研究論文。本研究開(kāi)發(fā)了一種由硅羅丹明(SiR)作為光氧化還原催化劑,在近紅外光(660 nm)觸發(fā)下實(shí)現(xiàn)ONB的高效光脫籠的方法,該方法可以在體外及體內(nèi)實(shí)現(xiàn)ONB的光脫籠,為利用近紅外光實(shí)現(xiàn)生物系統(tǒng)的時(shí)空調(diào)控提供了新的工具。

研究背景
光作為一種外部刺激源,能以極高的時(shí)空精度調(diào)控生物過(guò)程。光脫籠(即通過(guò)光照解離保護(hù)基團(tuán)以釋放被保護(hù)的生物活性分子)是調(diào)控小分子(如藥物、神經(jīng)遞質(zhì)、激素)和大分子(如蛋白質(zhì)、寡核苷酸)的常用策略。從19世紀(jì)60年代被發(fā)現(xiàn)光脫籠功能以來(lái),鄰硝基芐基(ONB)基團(tuán)憑借其分子尺寸小和光脫籠效率高的優(yōu)勢(shì),已成為應(yīng)用最廣泛的光籠基團(tuán)。然而,ONB的高效光裂解通常依賴于紫外或藍(lán)光,這類(lèi)光不僅對(duì)生物體系具有光毒性,組織穿透能力也有限。相比之下,近紅外(NIR)光具有更深的組織穿透性、更高的空間精度及更低的光損傷風(fēng)險(xiǎn),因此開(kāi)發(fā)基于NIR的光脫籠技術(shù)具有顯著優(yōu)勢(shì)。
盡管近年來(lái)多種響應(yīng)近紅外光的光籠基團(tuán)/分子已被開(kāi)發(fā),但其復(fù)雜的合成路線、大分子量導(dǎo)致的溶解性差等問(wèn)題限制了實(shí)際應(yīng)用。雙光子脫籠策略雖能利用近紅外光激發(fā),但ONB基團(tuán)的雙光子敏感性較低,且依賴昂貴的專用設(shè)備。上轉(zhuǎn)換納米粒子(UCNPs)介導(dǎo)的光活化方案則受限于納米顆粒的細(xì)胞滲透性差、上轉(zhuǎn)換效率不高,以及980 nm激發(fā)光與水分子吸收峰重合引發(fā)的組織熱效應(yīng)。因此,開(kāi)發(fā)一種通用性強(qiáng)、操作簡(jiǎn)便(使用易得設(shè)備和試劑)的ONB近紅外光脫籠新方法顯得尤為迫切。
研究?jī)?nèi)容
清華大學(xué)儲(chǔ)凌課題組開(kāi)發(fā)了一種創(chuàng)新策略:利用硅羅丹明(SiR)作為光氧化還原催化劑,在近紅外光(660 nm)觸發(fā)下實(shí)現(xiàn)ONB的高效光脫籠。該反應(yīng)在多種底物上均取得高產(chǎn)率,涵蓋氨基酸、核苷酸、前藥、生物活性小分子、熒光染料和蛋白質(zhì)等。機(jī)理研究表明,脫籠過(guò)程通過(guò)單電子轉(zhuǎn)移(SET)機(jī)制引發(fā)硝基還原,隨后發(fā)生電子級(jí)聯(lián)觸發(fā)的自消除反應(yīng)。該技術(shù)成功應(yīng)用于哺乳動(dòng)物細(xì)胞和細(xì)菌體系。更重要的是,團(tuán)隊(duì)進(jìn)一步開(kāi)發(fā)了針對(duì)非內(nèi)化性癌細(xì)胞表面標(biāo)志物的抗體-藥物偶聯(lián)物(ADC)的NIR光控前藥釋放方案,并在荷瘤小鼠模型中驗(yàn)證了其體內(nèi)應(yīng)用的有效性。
圖1. 近紅外光介導(dǎo)的ONB脫籠策略
首先,經(jīng)過(guò)對(duì)催化劑和反應(yīng)條件的系統(tǒng)篩選,確定含羧酸基團(tuán)的 SiR-2 為最優(yōu)催化劑。在無(wú)氧條件下,以還原劑 NADH 作為電子供體,該催化體系能在水環(huán)境中高效實(shí)現(xiàn)多種底物的光脫籠(表1)。該催化體系成功應(yīng)用于包括氨基酸、核苷酸、熒光探針、抗癌和抗菌藥物及生物大分子在內(nèi)的數(shù)十種底物,均展現(xiàn)出優(yōu)異的適用性。例如:半胱氨酸與脫氧寡核苷酸的脫籠產(chǎn)率達(dá) 85–99%,為基因調(diào)控工具開(kāi)發(fā)提供了新途徑。抗癌前藥單甲基澳瑞他汀 E (MMAE) 和喜樹(shù)堿 (CPT) 的釋放效率 >90%,凸顯其在精準(zhǔn)化療中的應(yīng)用潛力。值得注意的是,傳統(tǒng)上對(duì)紫外光敏感的疊氮苯和二苯甲酮基團(tuán),在 NIR 光照下也分別實(shí)現(xiàn)了 99% 和 82% 的高效脫籠,有效規(guī)避了紫外光源可能引發(fā)的副反應(yīng)風(fēng)險(xiǎn)。這些結(jié)果充分證明了該技術(shù)在近紅外光控釋放多種生物活性分子(從小分子前藥到生物大分子)方面具有廣泛的適用性和高效性。
表1. 近紅外光介導(dǎo)的 ONB 脫籠反應(yīng)的底物范圍
為驗(yàn)證在蛋白水平上的脫籠效果,該研究將末端含有ONB基團(tuán)的Halo配體與Halo蛋共價(jià)結(jié)合,獲得蛋白模型復(fù)合Halo-HTL-NO?(圖 2A)。高分辨質(zhì)譜分析顯示,經(jīng)NIR光照30分鐘后,復(fù)合物對(duì)應(yīng)的分子離子峰質(zhì)量數(shù)降低了133.5 Da,強(qiáng)有力地證實(shí)ONB光籠基團(tuán)被成功脫除,從而釋放出Halo與其配體HTL的復(fù)合物(Halo-HTL)(圖 2B)。這一光控的Halo標(biāo)簽系統(tǒng)為活細(xì)胞內(nèi)蛋白質(zhì)功能的原位、時(shí)空高精度調(diào)控提供了有力工具,有望推動(dòng)蛋白質(zhì)動(dòng)態(tài)行為的深組織層面研究。
圖 2. 近紅外光介導(dǎo)的籠狀Halo-Tag蛋白的光脫籠
為闡明光催化脫籠反應(yīng)的機(jī)理,研究者開(kāi)展了系統(tǒng)的實(shí)驗(yàn)驗(yàn)證。對(duì)照實(shí)驗(yàn)證實(shí),光催化脫籠反應(yīng)需同時(shí)依賴光照、催化劑SiR-2和還原劑NADH(圖3A,B)。自由基捕獲實(shí)驗(yàn)顯示,加入淬滅劑TEMPO可完全抑制反應(yīng)(圖3B),暗示自由基中間體的參與。電子轉(zhuǎn)移路徑研究發(fā)現(xiàn):無(wú)底物時(shí),藍(lán)色反應(yīng)液光照10分鐘后褪色,停止光照后緩慢復(fù)藍(lán);而無(wú) NADH 時(shí)無(wú)此現(xiàn)象(圖3C)。吸收光譜驗(yàn)證該顏色變化源于,激發(fā)態(tài)SiR-2* 被NADH還原為無(wú)色自由基(PC·?)。進(jìn)一步通過(guò)電子順磁共振(EPR)和質(zhì)譜分析直接檢測(cè)到自由基信號(hào),HRMS鑒定出了NADH-DMPO與SiR2-DMPO加合物的生成,證實(shí)了自由基的生成。此外,還對(duì)催化劑的進(jìn)行了電化學(xué)檢測(cè)(圖3D)。基于這些證據(jù),研究者提出了圖 3E 所示的機(jī)制途徑。該過(guò)程始于SiR-2在光照下被光活化,生成激發(fā)態(tài)(SiR-2*),隨后被 NADH 還原。還原的催化劑通過(guò)單電子轉(zhuǎn)移(SET)向 ONB 底物轉(zhuǎn)移一個(gè)電子并返回基態(tài)。ONB 基團(tuán)接收電子后被還原為羥胺并發(fā)生自降解,最終生成目標(biāo)產(chǎn)物。
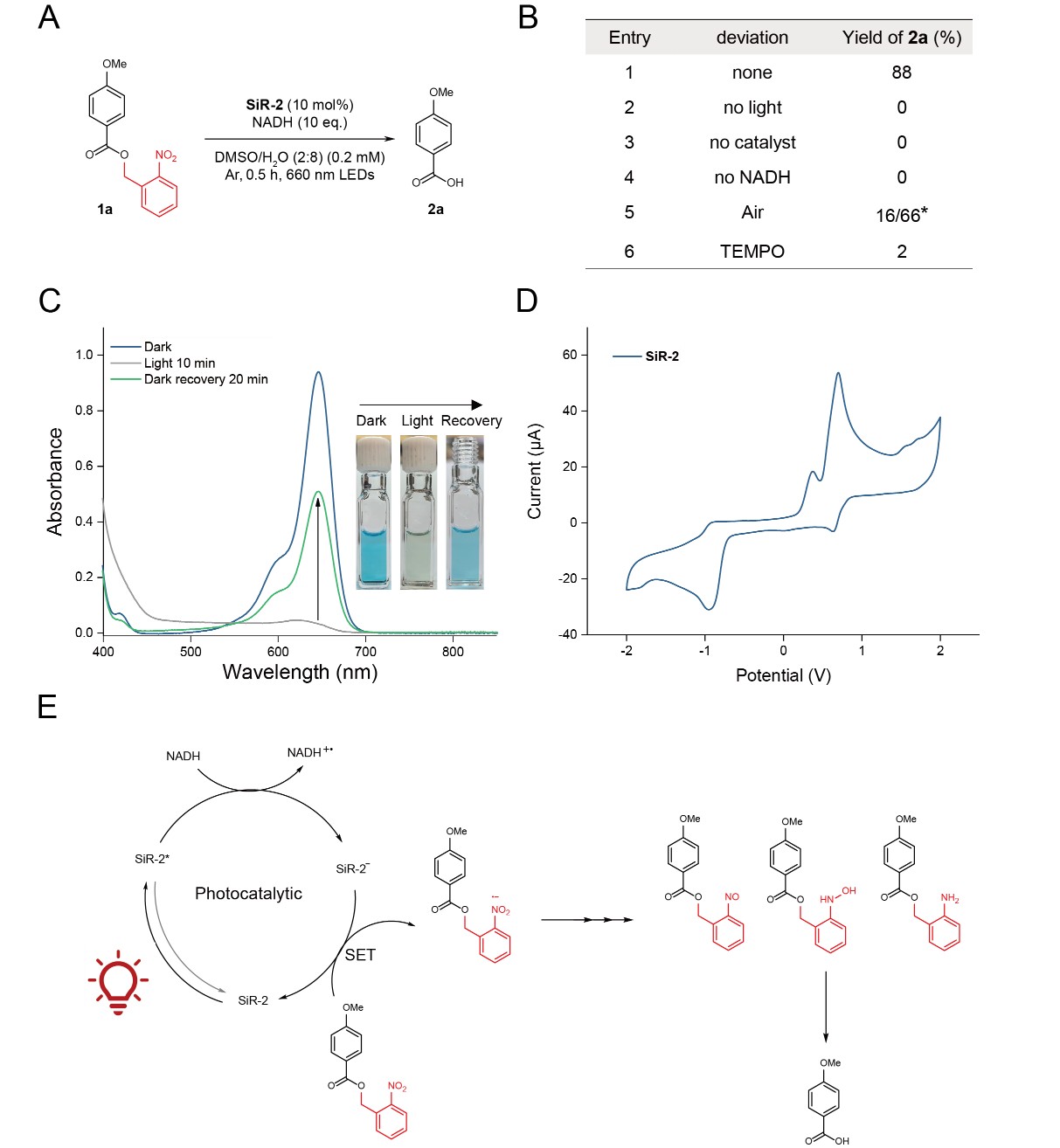
圖 3. 光催化脫籠機(jī)理研究
在活細(xì)胞水平的功能驗(yàn)證進(jìn)一步彰顯了該技術(shù)的實(shí)用性。如圖4所示,在缺氧培養(yǎng)的人骨肉瘤細(xì)胞(U2OS)中,被ONB基團(tuán)淬滅的熒光探針MeRho-NO?經(jīng)SiR-2催化后熒光信號(hào)增強(qiáng)(圖4C),流式細(xì)胞術(shù)定量顯示脫籠效率達(dá)46%(圖4D)。在抗菌實(shí)驗(yàn)中,將抗菌藥甲氧芐啶(TMP)設(shè)計(jì)為前藥TMP-NO?,通過(guò)在大腸桿菌培養(yǎng)體系使用NIR光照,用于催化藥物脫籠釋放(圖4E)。實(shí)驗(yàn)結(jié)果顯示:僅當(dāng)同時(shí)存在催化劑SiR-2、還原劑NADH及660 nm光照時(shí),細(xì)菌存活率顯著下降,而前藥本身幾乎無(wú)毒性,充分驗(yàn)證了光控抗菌策略的可行性(圖4F)。
圖4. 在活細(xì)胞中驗(yàn)證近紅外光催化熒光探針和抗菌藥物的脫籠
針對(duì)傳統(tǒng)抗體偶聯(lián)藥物(ADC)依賴癌細(xì)胞抗原內(nèi)吞才能釋放毒素的局限,該研究構(gòu)建了靶向PD-L1抗體(Avelumab)的非內(nèi)化型ADC(MMAE-NBC-Amab)。該設(shè)計(jì)利用ONB衍生的NBC連接子橋接抗體與抗癌毒素MMAE,使其僅在NIR光照下脫籠并恢復(fù)藥物活性。在4T1乳腺癌細(xì)胞模型中,缺氧環(huán)境下使用NIR光照,結(jié)果顯示ADC治療組細(xì)胞存活率顯著降低,而黑暗對(duì)照組則無(wú)顯著毒性。此外,在4T1荷瘤小鼠活體實(shí)驗(yàn)中,瘤內(nèi)注射ADC、SiR-2與NADH,輔以單次10分鐘660 nm激光照射(0.5 W/cm2),僅四次治療即實(shí)現(xiàn)腫瘤體積增長(zhǎng)的顯著抑制,且所有治療組小鼠均無(wú)體重下降或死亡。
圖5. 近紅外光介導(dǎo)的抗體藥物偶聯(lián)物體內(nèi)和體外光脫籠
總之,本研究開(kāi)發(fā)了一種基于硅羅丹明(SiR)作為光氧化還原催化劑、通過(guò)近紅外光(NIR)觸發(fā)oNB基團(tuán)脫籠的新型方法。該反應(yīng)在低氧條件下利用外源NADH作為添加劑高效進(jìn)行,具有極低的細(xì)胞毒性及廣泛的底物兼容性。我們證明該反應(yīng)可在細(xì)胞培養(yǎng)基及細(xì)胞表面進(jìn)行。我們預(yù)期該方案可被廣泛應(yīng)用于體外及體內(nèi)研究,為利用近紅外光實(shí)現(xiàn)生物系統(tǒng)的時(shí)空調(diào)控提供了可能。
致謝
清華大學(xué)藥學(xué)院儲(chǔ)凌副教授、深圳市第二人民醫(yī)院的黃衛(wèi)人研究員為本文的共同通訊作者,博士后閆瀟灑為本文的第一作者,清華大學(xué)藥學(xué)院的杜娟娟老師、清華大學(xué)化學(xué)系的郭興偉老師、焦雷老師、上海交通大學(xué)化學(xué)化工學(xué)院的陳剛老師及中國(guó)科學(xué)院化學(xué)研究所的程靚老師為本文提供了重要的實(shí)驗(yàn)支持。
論文鏈接:https://pubs.acs.org/doi/10.1021/jacs.5c04942

