最新科研速遞
2025年7月31日,清華大學(xué)藥學(xué)院秦為課題組在美國(guó)化學(xué)會(huì)期刊ACS central science上發(fā)表了題為“Precise and in vivo-compatible spatial proteomics via bioluminescence-triggered photocatalytic proximity labeling”的文章。該研究開(kāi)發(fā)了一種基于生物發(fā)光共振能量轉(zhuǎn)移(BRET)的新型鄰近標(biāo)記技術(shù),該方法有精準(zhǔn)的標(biāo)記半徑,并兼具活體環(huán)境的適用性。

細(xì)胞內(nèi)蛋白質(zhì)之間的相互作用構(gòu)成了維系生命活動(dòng)的基本網(wǎng)絡(luò)。這些蛋白質(zhì)常以穩(wěn)定或動(dòng)態(tài)的方式組裝于特定的亞細(xì)胞區(qū)域,形成具有功能特異性的“亞細(xì)胞社群”,共同參與細(xì)胞的代謝、信號(hào)轉(zhuǎn)導(dǎo)、應(yīng)激響應(yīng)等多種關(guān)鍵過(guò)程。以哺乳動(dòng)物細(xì)胞為例,細(xì)胞內(nèi)部高度區(qū)室化,不同蛋白在空間上呈現(xiàn)動(dòng)態(tài)分布。例如,在應(yīng)激顆粒(stress granules, SGs)等無(wú)膜細(xì)胞器中,大量蛋白可被招募進(jìn)入,并根據(jù)其結(jié)合親和力和動(dòng)力學(xué)行為被劃分為“核心”與“外殼”蛋白,構(gòu)成凝聚體結(jié)構(gòu)。這些復(fù)雜的亞細(xì)胞結(jié)構(gòu)對(duì)蛋白質(zhì)功能的實(shí)現(xiàn)和調(diào)控具有重要意義。
空間蛋白質(zhì)組學(xué)被Nature methods雜志評(píng)選為2024年的年度技術(shù),鄰近標(biāo)記(Proximity Labeling, PL)技術(shù)在空間蛋白質(zhì)組學(xué)中顯示出獨(dú)特優(yōu)勢(shì)。其中,光催化鄰近標(biāo)記通過(guò)外源光照激活光催化劑觸發(fā)標(biāo)記反應(yīng),具有很高的時(shí)間分辨率,為捕捉快速、動(dòng)態(tài)的蛋白互作事件提供了全新路徑。該技術(shù)通常將HaloTag與靶蛋白融合,通過(guò)HaloTag連接光催化劑,從而實(shí)現(xiàn)遺傳編碼的靶蛋白鄰近標(biāo)記解析。然而,外源光照除了可以激活HaloTag上偶聯(lián)的光催化劑,同樣也會(huì)激活細(xì)胞里游離的光催化劑,包括FMN(黃素單核苷酸)等內(nèi)源光敏小分子,從而帶來(lái)較高的非特異標(biāo)記。同時(shí),可見(jiàn)光照射也會(huì)帶來(lái)較大的細(xì)胞毒性,影響正常生理功能。更為重要的是,可見(jiàn)光的組織穿透力較差,因此限制了光催化鄰近標(biāo)記在活體動(dòng)物中的應(yīng)用。因此,亟需開(kāi)發(fā)低背景、低毒性和活體兼容的光催化鄰近標(biāo)記技術(shù),推動(dòng)其在活體生物學(xué)體系中的時(shí)空蛋白質(zhì)組學(xué)應(yīng)用。
為克服以上挑戰(zhàn),秦為課題組開(kāi)發(fā)了新型光催化鄰近標(biāo)記技術(shù)——BRET-ID(圖1),該技術(shù)利用熒光素酶NanoLuc在細(xì)胞內(nèi)產(chǎn)生生物源光,并通過(guò)生物發(fā)光共振能量轉(zhuǎn)移(BRET)效應(yīng)激活相鄰遺傳編碼的光催化劑,而游離的光敏小分子則因?yàn)榫嚯x效應(yīng)無(wú)法被激活,克服了其帶來(lái)的非特異標(biāo)記和毒性問(wèn)題。同時(shí),NanoLuc及其底物furimazine已經(jīng)被證明在活體成像中具有廣泛應(yīng)用性,它取代外源光照后也將賦予光催化鄰近標(biāo)記以活體兼容性。
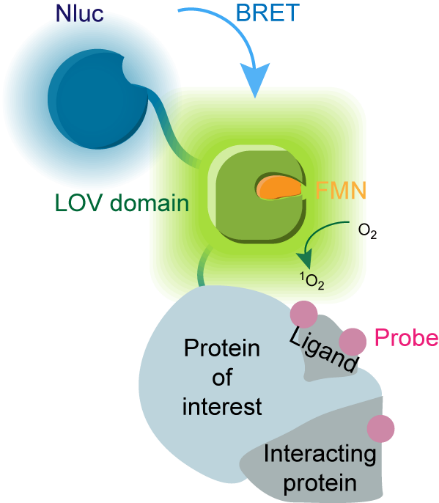
圖1. BRET-ID示意圖
團(tuán)隊(duì)首先利用BRET-ID技術(shù)對(duì)內(nèi)質(zhì)網(wǎng)膜(ERM)進(jìn)行空間蛋白質(zhì)組學(xué)分析,證明了其高空間特異性與低標(biāo)記背景。相比于藍(lán)光激活的光催化標(biāo)記,BRET-ID在無(wú)空間對(duì)照的條件下即可實(shí)現(xiàn)精準(zhǔn)標(biāo)記,顯著減少細(xì)胞質(zhì)非特異性蛋白的假陽(yáng)性,避免內(nèi)源光敏劑誘導(dǎo)的廣泛背景信號(hào)。BRET-ID富集的蛋白更集中于ERM及其相關(guān)膜結(jié)構(gòu),而藍(lán)光標(biāo)記方法中富集的蛋白則大多數(shù)是胞質(zhì)蛋白(圖2)。
圖3.(A)BRET-ID標(biāo)記示意圖,用于在DAMGO誘導(dǎo)的內(nèi)吞作用期間繪制hMOR相互作用蛋白 (B)BRET-ID鑒定到的hMOR相互作用蛋白的PLA驗(yàn)證 (C)BRET-ID標(biāo)記示意圖,用于SG蛋白組的繪制 (D)BRET-ID鑒定到的壓力條件下SG蛋白圖譜 (E)成像驗(yàn)證鑒定得到的蛋白與SG的共定位
為了驗(yàn)證BRET-ID的活體兼容性,我們?cè)谛∈竽[瘤模型中進(jìn)行了標(biāo)記實(shí)驗(yàn),首次描繪了G3BP1在活體環(huán)境下的互作圖譜。共鑒定出268個(gè)顯著富集蛋白,涵蓋多個(gè)相分離能力強(qiáng)的RNA結(jié)合蛋白,顯示出與體外數(shù)據(jù)的顯著差異,強(qiáng)調(diào)了體內(nèi)鄰近標(biāo)記對(duì)解析病理狀態(tài)下蛋白網(wǎng)絡(luò)的獨(dú)特價(jià)值。同時(shí),NanoLuc的生物發(fā)光適用于活體成像,因此BRET-ID具備實(shí)現(xiàn)在活體動(dòng)物中靶蛋白的同時(shí)成像和標(biāo)記。
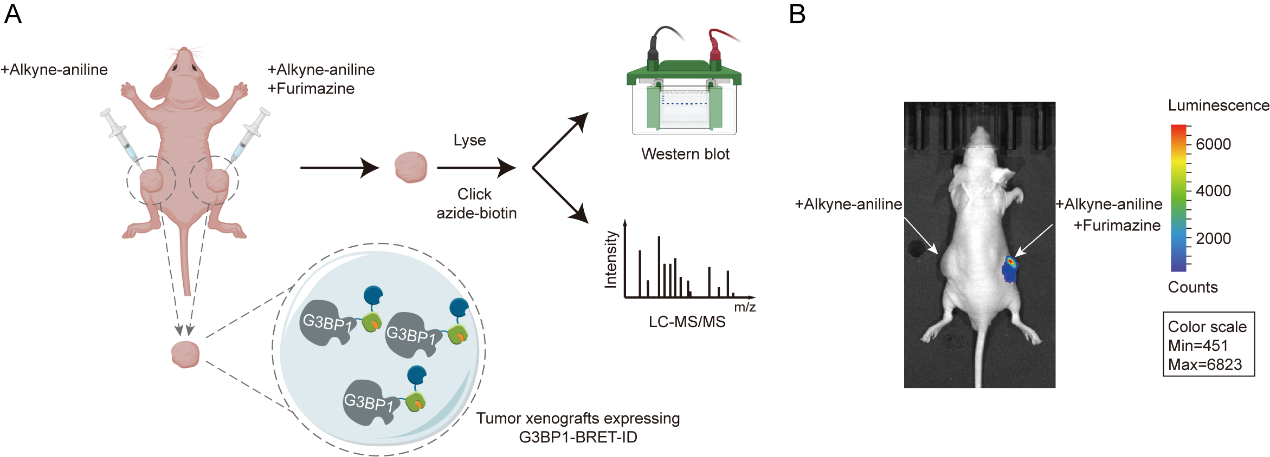
圖4.(A)BRET-ID標(biāo)記示意圖,用于繪制體內(nèi)G3BP1的相互作用蛋白 (B)小動(dòng)物熒光成像顯示BRET-ID在體內(nèi)保持活性
論文鏈接https://pubs.acs.org/doi/10.1021/acscentsci.5c00520?sessionid=

