最新科研速遞

2025年8月30日,清華大學藥學院儲凌、秦為課題組在《Nature Communications》期刊發(fā)表了題為“Silicon-rhodamine-enabled Identification for Near-Infrared Light Controlled Proximity Labeling In Vitro and In Vivo”的研究論文。本研究開發(fā)了一種基于硅羅丹明(SiR)的近紅外光控鄰近標記技術(SeeID),通過巧妙整合硅羅丹明的熒光與光催化特性,成功連接了熒光成像與鄰近標記技術,為活細胞與體內動態(tài)蛋白質互作組研究提供了全新工具。
在現(xiàn)代生命科學研究中,蛋白質的動態(tài)變化與相互作用是理解細胞功能、疾病機制的核心。熒光成像技術雖能以超高時空分辨率追蹤蛋白質定位與動態(tài),卻無法揭示成像背后的分子互作網絡;傳統(tǒng)鄰近標記技術(PL)雖能通過質譜分析捕獲蛋白質互作組,卻只能提供單時間點的 “快照”,且難以實現(xiàn)實時動態(tài)追蹤。這一技術鴻溝嚴重制約了對復雜生物學過程的深入解析。為此,清華藥學院儲凌、秦為課題組合作開發(fā)了一種基于硅羅丹明(SiR)的近紅外光控鄰近標記技術(SeeID),成功填補了這一空白,實現(xiàn)了活細胞與體內環(huán)境下 “成像追蹤 - 互作分析” 的一體化研究。
SeeID 技術的核心創(chuàng)新在于對硅羅丹明(SiR)分子功能的雙重開發(fā) —— 將其同時作為熒光團與光催化劑,結合 Halo-Tag 等自標記標簽,構建起近紅外光調控的鄰近標記體系。SiR 分子具有獨特的熒光特性,其在水溶液或疏水環(huán)境中以非熒光的螺環(huán)形式存在,而與 Halo-Tag 共價結合后會轉變?yōu)闊晒獾膬尚噪x子形式,這一 “熒光開關” 特性確保了標記的高空間特異性,可有效減少非特異性背景。同時,在 660 nm 近紅外光照射下,結合態(tài)的 SiR 能通過能量轉移(EnT)途徑生成單線態(tài)氧,氧化鄰近蛋白質的組氨酸殘基,進而與生物素化或炔基化探針結合,實現(xiàn)對目標蛋白(POI)鄰近蛋白的共價標記,后續(xù)通過質譜(LC-MS/MS)即可解析互作組信息。
為驗證 SeeID 的性能,研究團隊首先開展了體外與細胞內的基準測試(圖1)。在體外實驗中,10 μM SiR-CA(硅羅丹明氯代烷衍生物)與 Halo 蛋白形成共價復合物后,經 660 nm LED 照射,可高效介導生物素化探針(如 BA)或炔基探針(如 3-EA)對鄰近蛋白的標記;通過單線態(tài)氧傳感器 SOSG 檢測及維生素 C(NaVc)淬滅實驗,證實了單線態(tài)氧在標記過程中的核心作用。更重要的是,SiR 的熒光特性使其僅在結合 Halo 蛋白時才高效生成單線態(tài)氧,而非熒光光敏劑亞甲藍(MB)則會無差別標記蛋白,凸顯了 SeeID 的低背景優(yōu)勢。
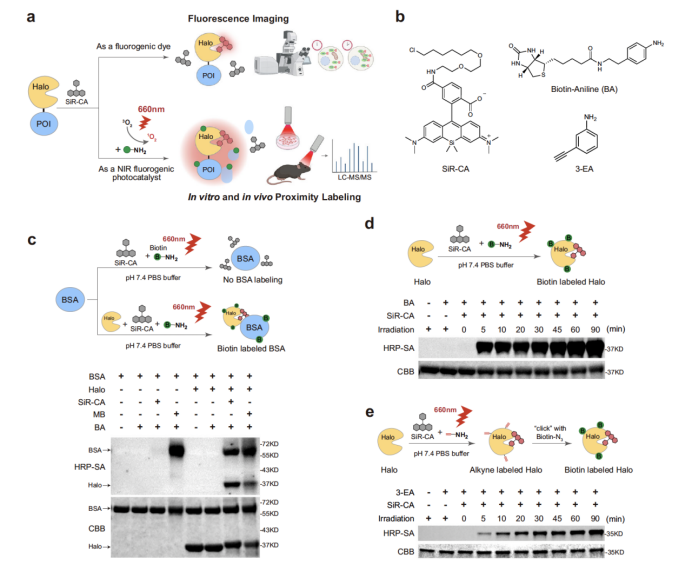
圖1. SeeID的體外驗證
在細胞水平,研究團隊優(yōu)化了標記條件,篩選出標記效率最高的炔基探針 3-EA,并對細胞核(NLS)、內質網(Sec61β)、線粒體(TOMM20)、溶酶體(LAMP1)等多種細胞器的特異性蛋白質組進行表征(圖2)。共聚焦成像顯示,SeeID 標記信號與細胞器標志物的皮爾遜相關系數(shù)(PCC)達 0.83-0.94,表明其極高的空間特異性;Western blot 與質譜分析進一步證實,不同細胞器的標記蛋白呈現(xiàn)出顯著的差異模式,且內質網膜(ERM)蛋白質組分析中,SeeID 成功鑒定出 284 種高置信度內質網膜蛋白,其中 90% 為已知分泌途徑蛋白,特異性媲美 miniSOG、TurboID 等主流鄰近標記技術,且優(yōu)于 APEX2(圖3)。
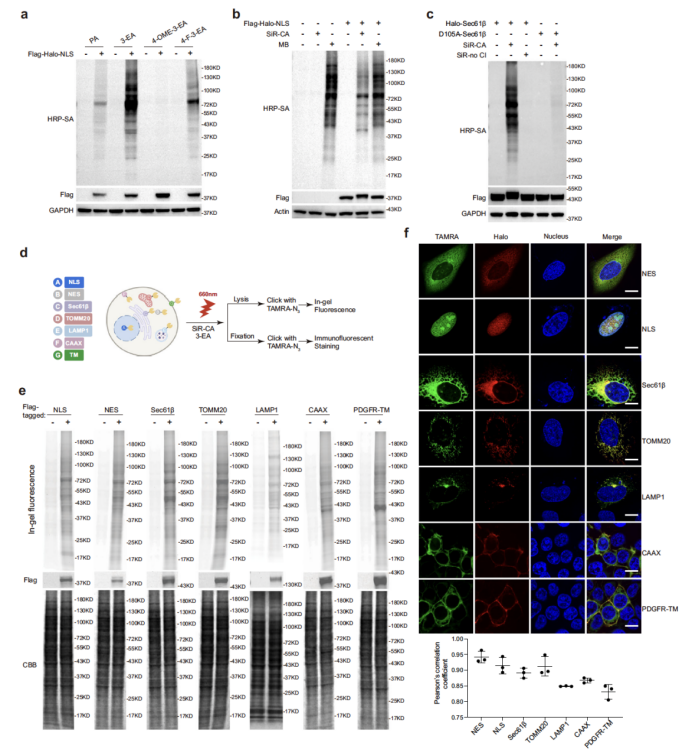
圖2. SeeID用于活細胞標記
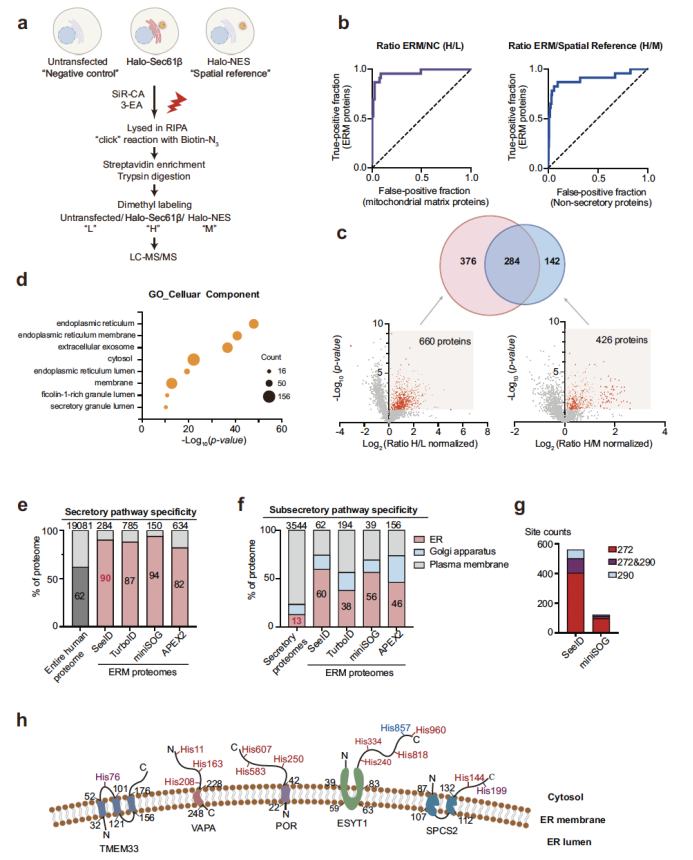
圖4. SeeID用于分析KRAS互作蛋白組
SeeID 的另一重要突破在于實現(xiàn)了動態(tài)蛋白質互作組的追蹤,研究團隊以 PINK1/Parkin 介導的線粒體自噬(mitophagy)為模型展開探索(圖5)。線粒體自噬是細胞清除受損線粒體的關鍵過程,Parkin 的 translocation 與動態(tài)互作是其核心調控環(huán)節(jié)。研究使用小分子 BL-918 誘導 Parkin translocation,通過活細胞成像實時追蹤到:0 h 時 Parkin 彌散分布于胞質,2 h 時形成囊泡樣聚集并開始向受損線粒體遷移,4 h 時完全定位于線粒體(PCC 從 0.44 升至 0.85)。同時,在這三個時間點通過 SeeID 捕獲 Parkin 的互作組,發(fā)現(xiàn) 2 h 時 45 種蛋白酶體復合物相關蛋白中有 29 種的豐度顯著上升(Ratio>1.5),而 4 h 時豐度下降。這一動態(tài)變化表明,泛素 - 蛋白酶體系統(tǒng)在 mitochondrial 自噬早期即參與受損線粒體蛋白的降解,此前尚未有研究通過鄰近標記技術揭示這一動態(tài)過程,凸顯了 SeeID 在動態(tài)生物學過程研究中的獨特價值。

圖5.基于熒光成像的Parkin動態(tài)蛋白互作組分析
近紅外光的深組織穿透性是 SeeID 的重要優(yōu)勢,研究團隊進一步驗證了其在體內的應用潛力——小鼠大腦的時空可控鄰近標記。通過立體定位注射,將攜帶 Halo-TM(細胞膜靶向 Halo 標簽蛋白)的 AAV 病毒導入小鼠海馬體與視覺皮層,待病毒表達 2-3 周后,在急性腦切片中,1 μM SiR-CA 與 500 μM BA 處理結合 660 nm LED 照射,可在海馬體區(qū)域觀察到強烈的特異性標記信號;而在在體實驗中,向小鼠視覺皮層注射 SiR-CA 與 BA 后,經 30 分鐘 660 nm LED 照射,標記深度可達約 2 mm,且質譜分析鑒定出 60 種富集蛋白,其中 62% 與膜、囊泡或細胞外基質相關,包括神經遞質受體(Gabra2、Gria1)、神經細胞黏附分子(Ncam1)等突觸相關蛋白,證實了 SeeID 在體內深層組織中研究特定區(qū)域蛋白質互作的能力。
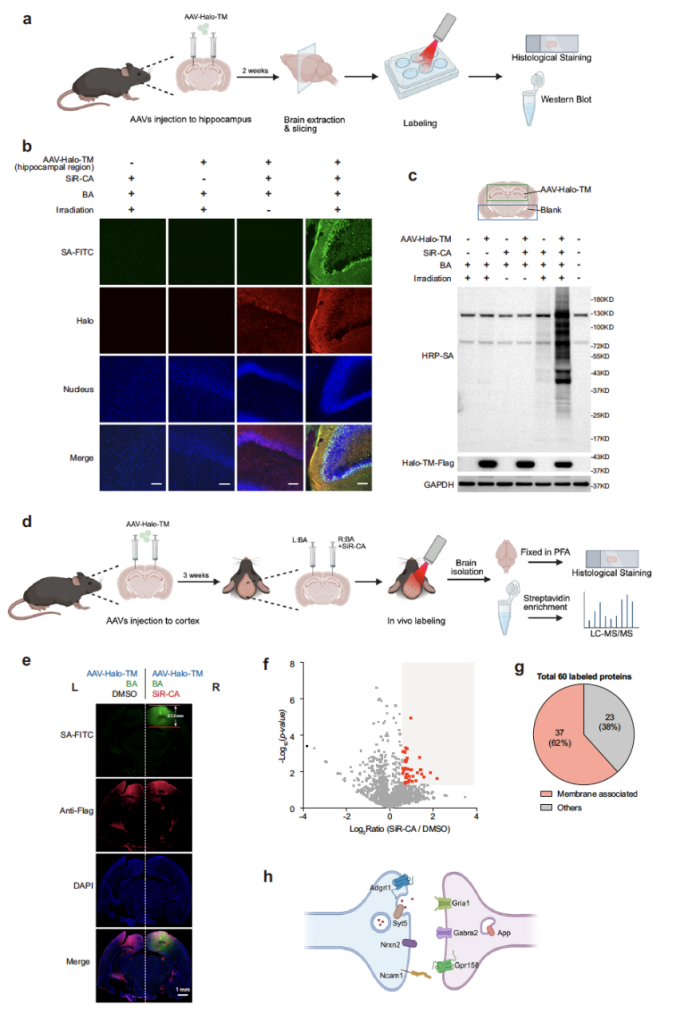
圖 6. SeeID在活體蛋白鄰近標記中的應用
相較于現(xiàn)有技術,SeeID 具有三大核心優(yōu)勢:一是 “成像 - 標記” 一體化,無需額外免疫染色即可實現(xiàn)目標蛋白動態(tài)追蹤與互作組分析的同步;二是近紅外光調控,660 nm 光對生物組織損傷小且穿透深,解決了藍光 / 綠光調控技術的組織穿透局限;三是低細胞毒性與高特異性,SiR-CA 的熒光特性使其僅在結合目標標簽后才激活標記,顯著降低非特異性背景與細胞損傷。當然,技術仍存在改進空間,如 SiR 的單線態(tài)氧生成效率有待提升,以進一步縮短照射時間、提高時間分辨率。
綜上,SeeID 技術通過巧妙整合硅羅丹明的熒光與光催化特性,成功連接了熒光成像與鄰近標記技術,為活細胞與體內動態(tài)蛋白質互作組研究提供了全新工具。其在細胞器生物學、癌癥機制、神經科學等領域的應用潛力,有望推動生命科學研究從 “靜態(tài)描述” 向 “動態(tài)解析” 的跨越,為疾病機制研究與藥物研發(fā)提供新的技術支撐。
清華大學藥學院儲凌副教授、秦為研究員為本文的共同通訊作者,博士后王文靜、博士研究生郭弘揚、博士后閆瀟灑為本文的共同第一作者,中國科學院遺傳與生物發(fā)育研究所武照伐研究員、清華大學生命學院趙昕宇老師為本文提供了重要的實驗支持。
論文鏈接:https://www.nature.com/articles/s41467-025-63496-x?sessionid=

