在天然免疫細胞中,環(huán)狀 GMP-AMP 合成酶(cGAS)是關(guān)鍵的胞質(zhì) DNA 傳感器,能夠識別微生物來源或異常的自身雙鏈 DNA(dsDNA)。cGAS 被激活后可催化合成環(huán)狀二核苷酸 2'3'-cGAMP,該分子進一步結(jié)合并激活適配蛋白 STING,從而啟動 TBK1-IRF3 信號通路并誘導(dǎo) I 型干擾素應(yīng)答。近期多項研究表明,大量 cGAS 定位于細胞核并與核小體結(jié)合,這種機制可能是用于防止自身 DNA的異常激活。然而,在免疫細胞中維持如此大量核cGAS蛋白的生物學(xué)意義仍不清楚,僅靠其物理隔離作用似乎不足以解釋其進化保守性。
有趣的是,cGAS 在富含 T 細胞的淋巴組織中普遍表達。在 CD8? T 細胞中,cGAS 可通過 AKT 依賴性機制維持中心記憶 T 細胞表型,從而增強抗腫瘤免疫。盡管 CD4? T 細胞也表達 cGAS,但其 DNA 識別能力卻主要依賴 KU 復(fù)合物,而非 cGAS,這一點可通過 DNA 刺激無法誘導(dǎo)這些細胞產(chǎn)生 cGAMP 或分泌干擾素-β 來證明。這表明我們對 cGAS 在適應(yīng)性免疫中,尤其是 CD4? T 細胞生物學(xué)中的功能仍缺乏完整理解。
2025年9月16日,清華大學(xué)藥學(xué)院尹航教授團隊在Cell 子刊Cell Reports發(fā)表了一篇題為“T cell-intrinsic cGAS-CTCF regulation maintains regulatory T cell development and function”的研究論文。該研究揭示了核cGAS在適應(yīng)性免疫中的STING非依賴性作用,建立了調(diào)控調(diào)節(jié)性T細胞(Treg)介導(dǎo)免疫耐受的cGAS-CTCF軸。在穩(wěn)態(tài)下,cGAS主要位于Treg細胞核內(nèi),而在na?ve CD4? T細胞受到刺激后,cGAS的轉(zhuǎn)錄被激活并轉(zhuǎn)位入核。通過T細胞和Treg特異性cGAS敲除小鼠實驗,研究表明cGAS在胸腺陽性選擇期間通過TNFRSF共刺激分子促進Treg分化,并穩(wěn)定FOXP3表達。在細胞和動物層面,cGAS能夠維持Treg的免疫抑制功能以及腫瘤免疫耐受。
cGAS 通過維持 TCR 信號傳導(dǎo)以促進 Treg 分化
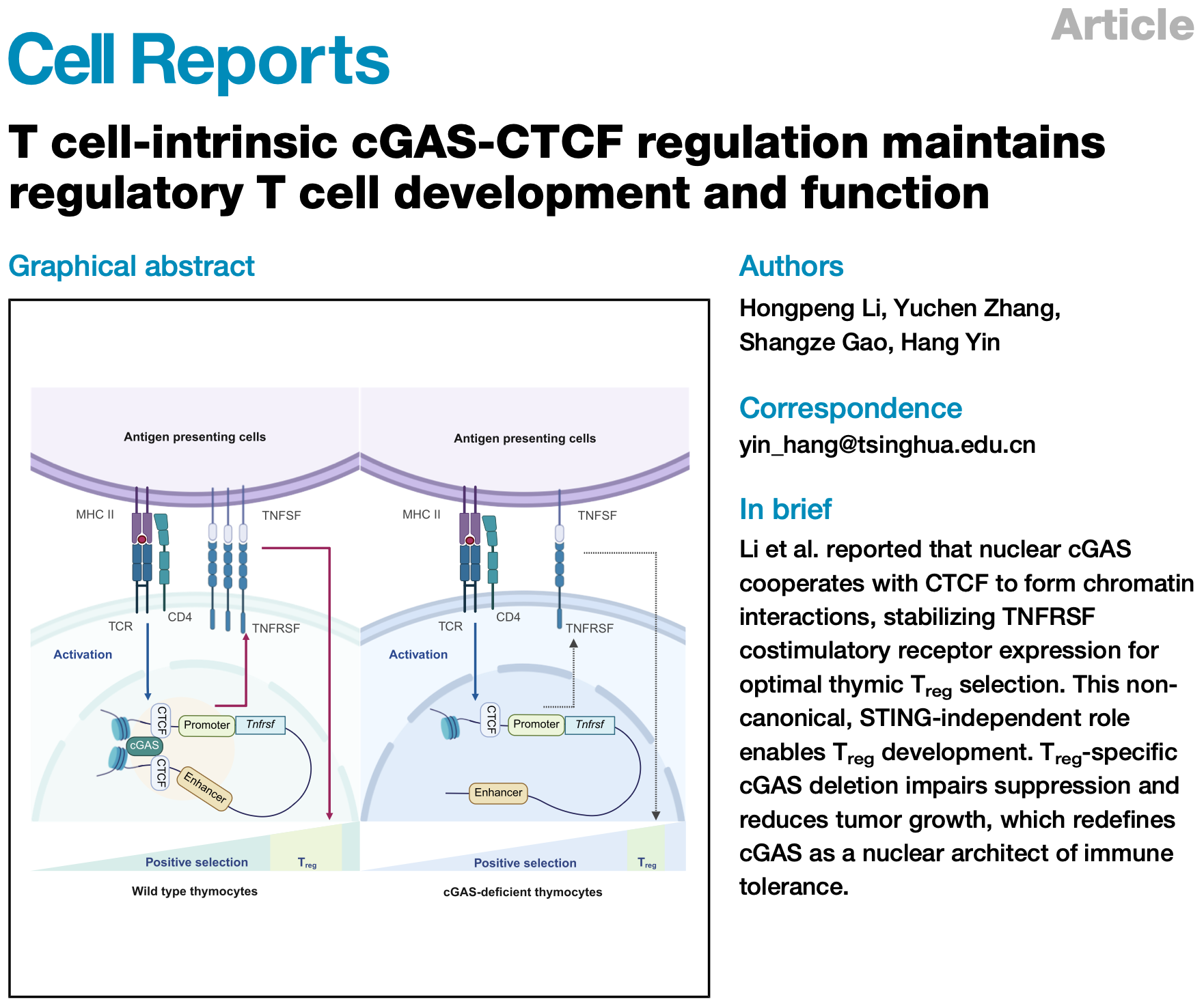
首先,作者通過流式分析發(fā)現(xiàn)cGAS敲除鼠的胸腺和脾臟Treg數(shù)量和比例明顯降低,且在與野生型骨髓的競爭性移植模型中也體現(xiàn)出類似的表型。進一步分析胸腺細胞亞群揭示陽性選擇明顯受損,而陰性選擇不受影響。利用scRNA-seq結(jié)合TCR測序?qū)d4CreCgasfl/fl與對照小鼠的CD4?CCR7?胸腺細胞進行轉(zhuǎn)錄組分析顯示,這些細胞可分為13個亞群,其中Treg前體特征性表達Tnfrsf9(4-1BB)、Tnfrsf4(OX40)及Tnfrsf18(GITR)。在cGAS缺失胸腺細胞中,F(xiàn)OXP3? Treg數(shù)量減少,成熟tTreg標(biāo)志基因Nt5e(CD73)表達下降。同時,TCR信號強度報告基因Nr4a1的轉(zhuǎn)錄水平在Treg前體、preTreg及Treg中均顯著減弱。TCR譜系分析進一步顯示,cGAS缺失胸腺細胞的TCR克隆型復(fù)雜度下降,且cGAS缺失Treg群體中TCR克隆呈過度擴增,提示其多樣性受損。綜上,cGAS通過增強陽性選擇中的TCR信號,維持tTreg分化與TCR庫多樣性。
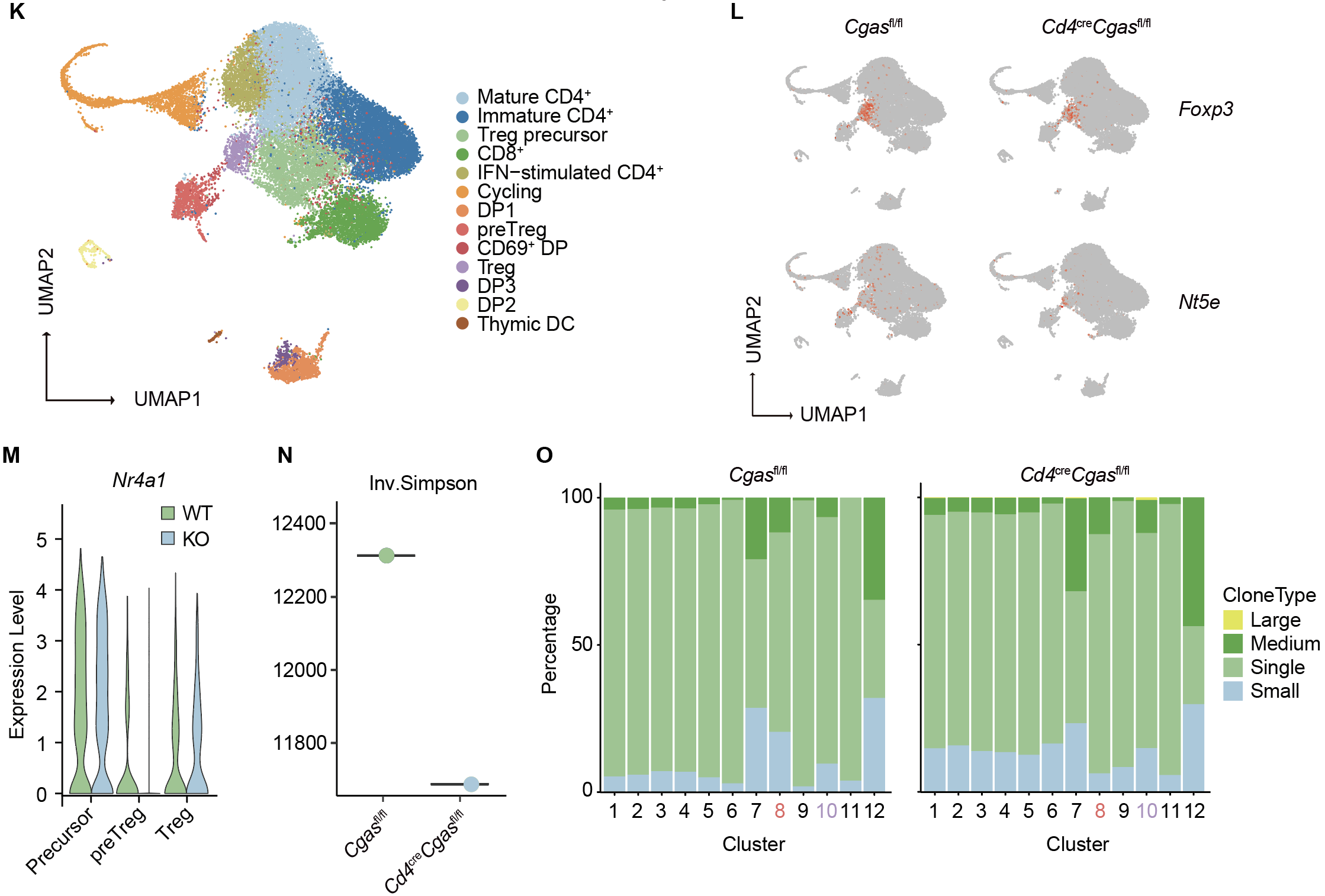
圖1. CD4?CCR7?胸腺細胞的scRNA-seq和TCR-seq分析
TNFRSFs 表達是 cGAS 介導(dǎo) Treg 發(fā)育的關(guān)鍵環(huán)節(jié)
在胸腺正選擇過程中,tTreg 前體依賴高強度 TCR 信號與 CD28 共刺激誘導(dǎo) c-Rel 表達,從而上調(diào) OX-40、GITR 等 TNFRSF 受體基因。單細胞轉(zhuǎn)錄組及流式分析提示,CD69?OX-40? 胸腺細胞可作為 DP 階段的早期 tTreg 前體標(biāo)志。我們發(fā)現(xiàn),cGAS 缺失并不影響 c-Rel 及 ThPOK、IRF4、Helios 等轉(zhuǎn)錄因子表達,說明 CD28 信號仍完整;但 CD69?OX-40? 比例及 OX-40 表達在前體階段即下降,后續(xù) CD25、NRP1、CD73 等成熟標(biāo)志物亦減少,關(guān)鍵的 CTLA-4 表達亦下調(diào)。胸腺選擇過程中正向信號總量決定 TCR 親和力閾值及庫的形成,而 TNFRSF 信號競爭對高親和力克隆偏倚具有決定性作用。作者發(fā)現(xiàn),體內(nèi)給予 4-1BB(TNFRSF9)激動性抗體可顯著增加 CD25?FOXP3lo 前體比例,并挽救 cGAS 缺失小鼠的缺陷,同時恢復(fù)其 TCR Vβ5? 克隆比例至野生型水平。這些結(jié)果表明,cGAS 通過維持 TNFRSF 表達和信號強度,保障 tTreg 的有效選擇和 TCR 庫的穩(wěn)態(tài)。
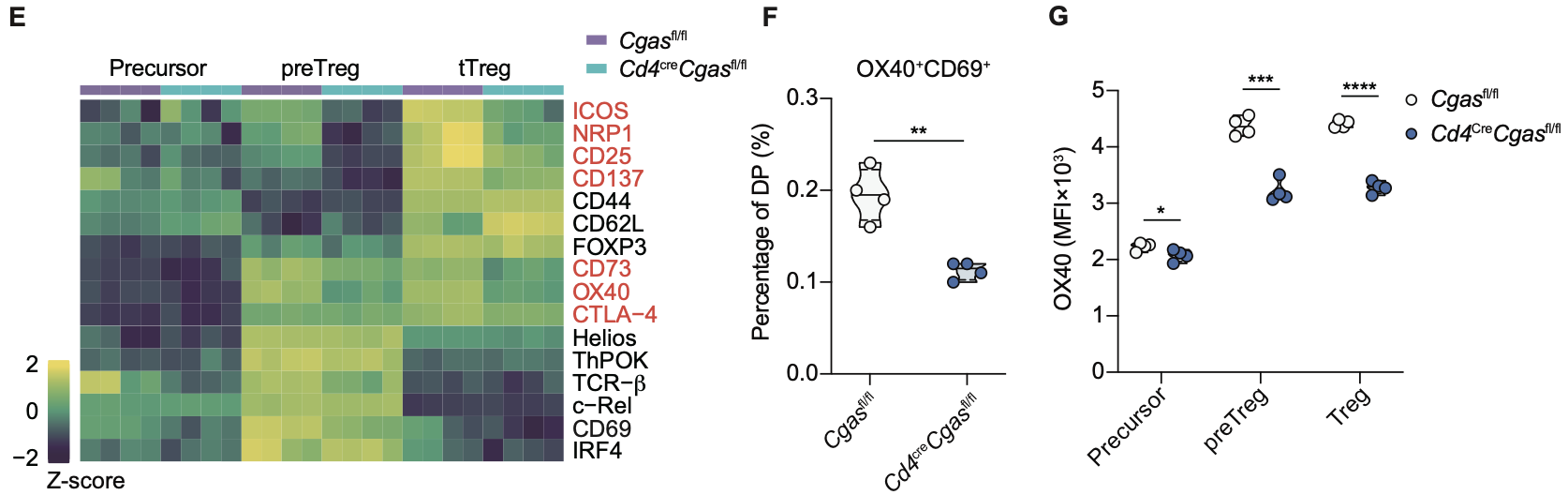
圖2. T細胞cGAS條件性敲除tTreg的光譜流式分析
cGAS 協(xié)同 CTCF 調(diào)控 Treg 的染色質(zhì)結(jié)構(gòu)
作者使用ATAC-seq揭示了CTCF是cGAS調(diào)控tTreg染色質(zhì)可及性的關(guān)鍵協(xié)作因子,并證明了cGAS與CTCF存在內(nèi)源性相互作用。通過in situ Hi-C和CTCF轉(zhuǎn)錄因子CUT&Run差異分析,研究發(fā)現(xiàn)cGAS維持了Treg基因組的染色質(zhì)環(huán)結(jié)構(gòu),且對招募CTCF至Tnfrsf位點起到關(guān)鍵作用。
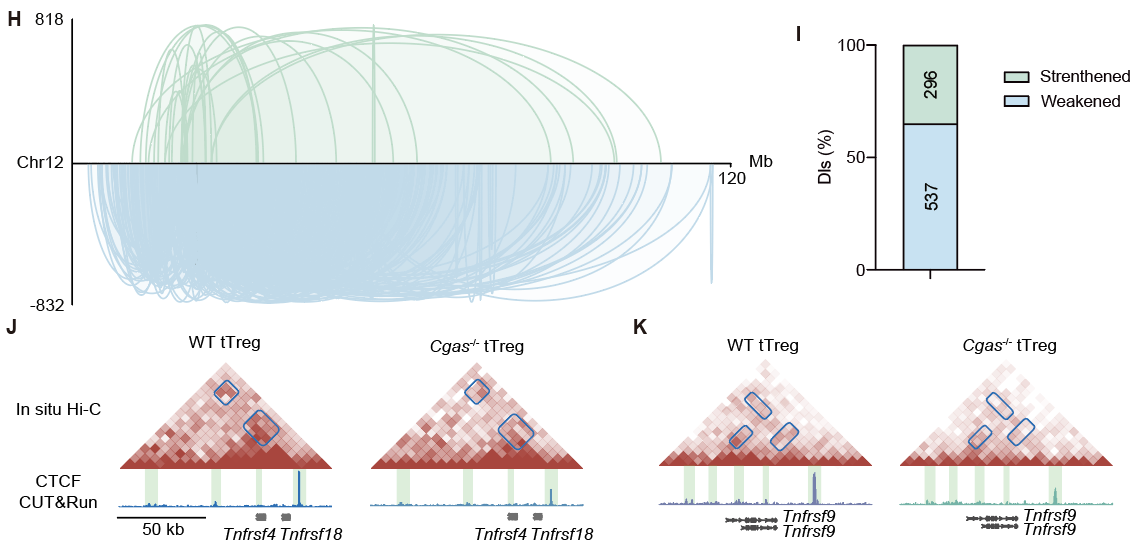
圖3. 野生型和cGAS缺失tTreg的in situ Hi-C差異分析
cGAS 對調(diào)節(jié)性 T 細胞在體內(nèi)外的抑制功能至關(guān)重要
作者通過體外抑制試驗證明了Treg的抑制功能依賴于cGAS。在 B16腫瘤模型中,Treg特異性缺失cGAS的小鼠(Foxp3Cre-YFPCgasfl/fl)表現(xiàn)出腫瘤體積和重量顯著下降,與Treg穩(wěn)定性受損的表型一致。單細胞流式分析顯示,這些小鼠的腫瘤內(nèi)Treg比例和數(shù)量減少,同時 CD8? T細胞比例增加,且其中耗竭型CD8? T細胞(Tex)減少。這表明,cGAS不僅維持Treg的發(fā)育,還在體內(nèi)外發(fā)揮關(guān)鍵的免疫抑制功能。
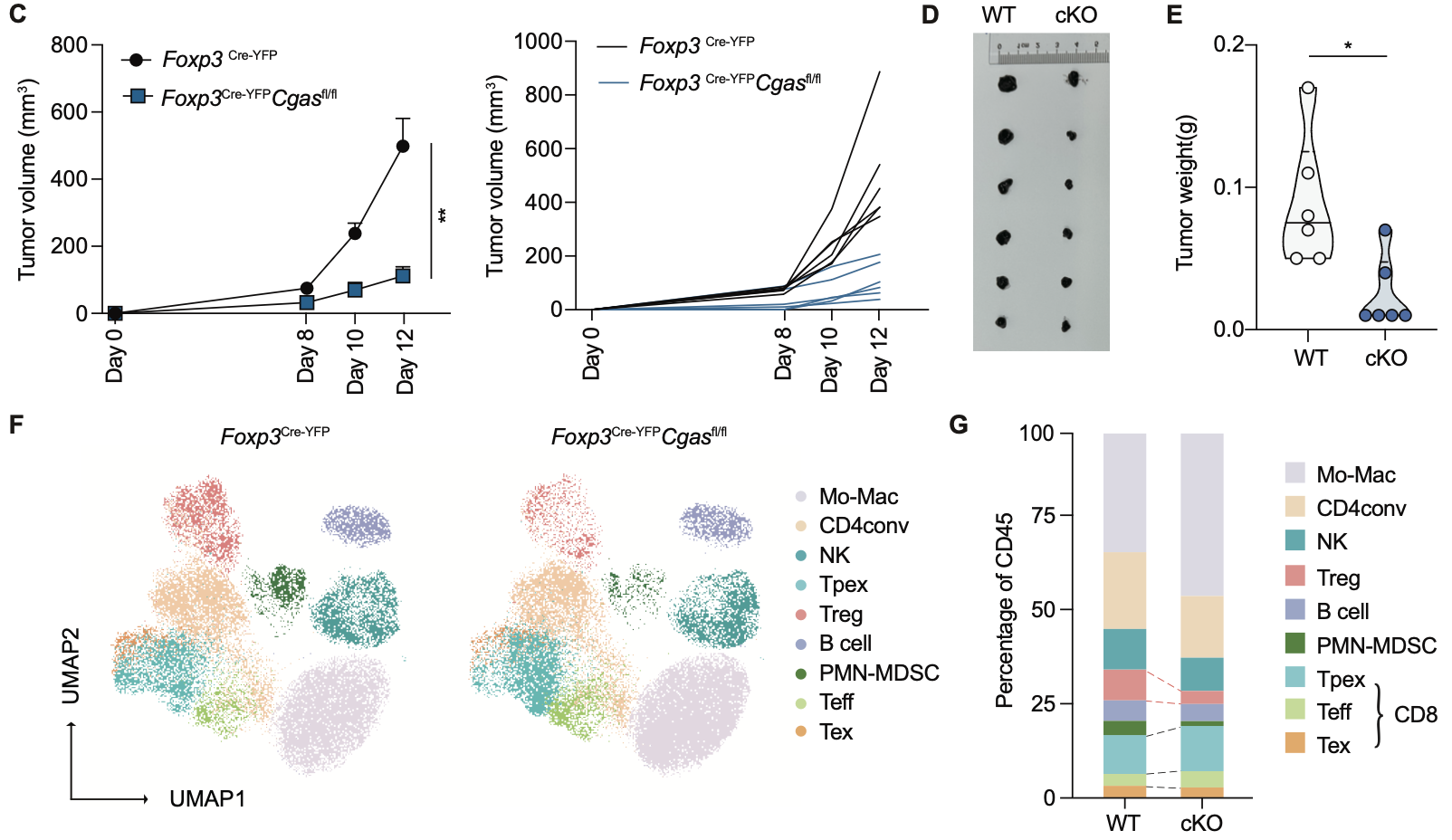
圖4. 野生型和Treg條件性cGAS敲除小鼠的B16腫瘤模型分析
綜上,本研究揭示了一種cGAS的STING非依賴性的胸腺Treg發(fā)育調(diào)控機制。cGAS與CTCF協(xié)作,通過染色質(zhì)重塑調(diào)控關(guān)鍵共刺激受體TNFRSF9和TNFRSF4的表達。Treg特異性cGAS敲除小鼠的Treg穩(wěn)定性受損,且黑色素瘤生長顯著減弱。這些發(fā)現(xiàn)不僅拓展了我們對cGAS在天然免疫范疇以外的認(rèn)識,也揭示了其在維持免疫耐受中的核內(nèi)功能。
該論文的第一作者是清華大學(xué)醫(yī)學(xué)實驗班(MD/PhD)李鴻鵬,通訊作者是清華大學(xué)藥學(xué)院尹航教授。該項研究得到了國家自然科學(xué)基金、清華大學(xué)學(xué)術(shù)研究推進計劃等項目資助。
完整文章鏈接:https://www.sciencedirect.com/science/article/pii/S2211124725010733?sessionid=

