最新科研速遞
2025年9月12日,清華大學(xué)藥學(xué)院杜娟娟團(tuán)隊(duì)與生命科學(xué)學(xué)院李丕龍團(tuán)隊(duì)在Journal of the American Chemical Society(JACS)上合作發(fā)表了題為“Immunoglobulin-Directed Phase Separation for Cell-Specific Modulation of Receptor Signaling”的研究論文。團(tuán)隊(duì)構(gòu)建了一種免疫球蛋白引導(dǎo)的相分離系統(tǒng)(IgPS),利用抗體與多價(jià)肽段的相互作用在細(xì)胞膜上驅(qū)動(dòng)特定受體形成凝聚體,從而實(shí)現(xiàn)受體的精準(zhǔn)聚集與信號(hào)放大。在靶向CXCR4和DR5的應(yīng)用中,IgPS能夠特異性誘導(dǎo)CXCR4?/DR5?腫瘤細(xì)胞凋亡;在小鼠腫瘤模型中,該系統(tǒng)亦顯著抑制腫瘤生長(zhǎng)。該研究不僅借助相分離的獨(dú)特生物物理特性,為膜受體的空間調(diào)控提供了全新工具,也為蛋白質(zhì)藥物的精準(zhǔn)設(shè)計(jì)和腫瘤靶向治療開(kāi)辟了新路徑,展示了相分離策略在生命科學(xué)與精準(zhǔn)醫(yī)學(xué)中的廣闊應(yīng)用前景。
蛋白質(zhì)藥物因其高特異性和在調(diào)控生物過(guò)程中發(fā)揮的關(guān)鍵作用,已成為治療多種疾病的重要手段。然而,在系統(tǒng)性給藥時(shí),這類藥物常因作用于非靶組織而產(chǎn)生副作用。如何實(shí)現(xiàn)蛋白質(zhì)藥物的精準(zhǔn)靶向,是提升療效與安全性的核心挑戰(zhàn)。
細(xì)胞膜上的受體是信號(hào)傳導(dǎo)的樞紐,但傳統(tǒng)抗體或小分子藥物往往難以精確調(diào)控受體的空間分布和聚集狀態(tài)。近年來(lái),研究發(fā)現(xiàn)液-液相分離(LLPS)可以將蛋白質(zhì)等生物分子局部濃縮,形成無(wú)膜的凝聚體,既延長(zhǎng)受體在膜上的駐留時(shí)間,又提高局部信號(hào)蛋白濃度,從而顯著放大信號(hào)。這為精準(zhǔn)調(diào)控膜受體提供了新思路。
研究團(tuán)隊(duì)建立了一種免疫球蛋白引導(dǎo)的相分離系統(tǒng)(IgPS)。他們首先設(shè)計(jì)了Fc突變體,以避免體內(nèi)內(nèi)源性抗體的干擾,并通過(guò)噬菌體展示篩選出特異性結(jié)合的肽段AIP1。隨后,將不同重復(fù)數(shù)的AIP1單元與熒光蛋白mCherry融合表達(dá),生成融合蛋白mCherry-AIP1n。當(dāng)這些融合蛋白與Fc突變體混合時(shí),形成液滴狀凝聚體,并表現(xiàn)出動(dòng)態(tài)分子交換特性。實(shí)驗(yàn)結(jié)果表明,凝聚體的形成依賴于突變Fc與肽段的多價(jià)相互作用;低價(jià)肽或野生型Fc均無(wú)法誘導(dǎo)液滴形成(圖1)。
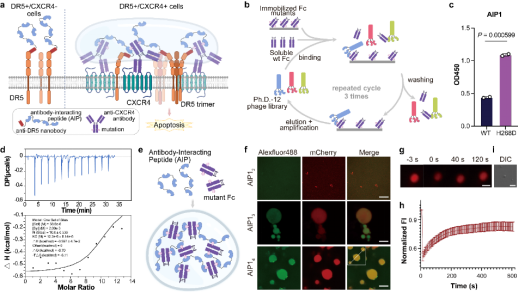
圖1 工程化相分離系統(tǒng)
研究團(tuán)隊(duì)構(gòu)建了DR5×CXCR4靶向的IgPS系統(tǒng),并驗(yàn)證了其在細(xì)胞膜上誘導(dǎo)液滴狀凝聚體形成、驅(qū)動(dòng)CXCR4與DR5共聚集的能力。在體外實(shí)驗(yàn)中,該系統(tǒng)能夠特異性激活DR5+/CXCR4+細(xì)胞的凋亡。將不同價(jià)態(tài)的靶向DR5的DNB-AIP1n與靶向CXCR4的CNB-mutFc組合使用時(shí),DNB-AIP13-5能夠有效誘導(dǎo)SJSA-1細(xì)胞凋亡,同時(shí)在Western blot中檢測(cè)到caspase-8、caspase-3和PARP的裂解。相比之下,該系統(tǒng)在DR5?/CXCR4?的HepG2細(xì)胞中未表現(xiàn)出明顯作用(圖2d)。進(jìn)一步的體內(nèi)實(shí)驗(yàn)表明,DNB-AIP14與CNB-mutFc聯(lián)合給藥后,DNB-AIP14在腫瘤部位顯著富集,并在NOD/SCID小鼠的SJSA-1異種移植瘤模型中表現(xiàn)出強(qiáng)效的抑瘤作用。與PBS對(duì)照組相比,聯(lián)合治療組的腫瘤在給藥三天后即開(kāi)始縮小,且在實(shí)驗(yàn)結(jié)束時(shí)平均體積明顯低于對(duì)照組,而DNB-AIP14單獨(dú)給藥僅產(chǎn)生輕微抑制效果。整體結(jié)果表明,DNB-AIP14/CNB-mutFc通過(guò)特異性誘導(dǎo)DR5+/CXCR4+細(xì)胞凋亡,有效抑制腫瘤生長(zhǎng)(圖2)。
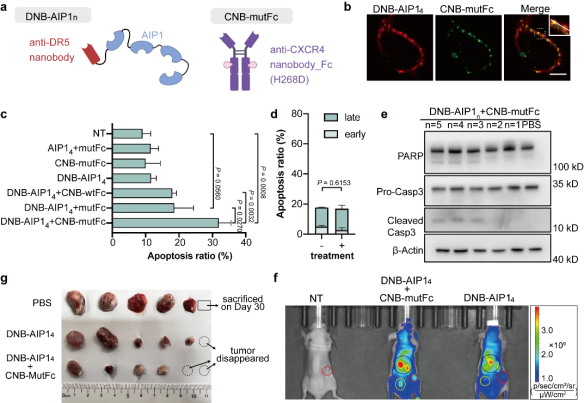
圖2 DNB-AIP1n/CNB-mutFc誘導(dǎo)CXCR4?/DR5? SJSA-1細(xì)胞凋亡
這項(xiàng)研究開(kāi)發(fā)了一種抗體引導(dǎo)的相分離(IgPS)策略,實(shí)現(xiàn)了對(duì)細(xì)胞表面受體的精確聚集與信號(hào)調(diào)控。該系統(tǒng)兼具抗體的高特異性、優(yōu)異穩(wěn)定性、延長(zhǎng)循環(huán)時(shí)間以及低免疫原性,同時(shí)肽-抗體突變體的特異性相互作用可有效降低體內(nèi)內(nèi)源抗體的干擾,使其在體內(nèi)應(yīng)用更加可靠。此外,IgPS系統(tǒng)通過(guò)多價(jià)作用實(shí)現(xiàn)對(duì)受體聚集狀態(tài)的細(xì)胞特異性調(diào)控,為精確調(diào)節(jié)受體功能提供了新的手段。展望未來(lái),該系統(tǒng)有望拓展至更多類型的細(xì)胞表面受體,實(shí)現(xiàn)細(xì)胞特異性的受體激動(dòng)或抑制,為精準(zhǔn)調(diào)控細(xì)胞信號(hào)傳導(dǎo)和開(kāi)發(fā)新型靶向治療提供潛在策略,同時(shí)也為解析復(fù)雜微環(huán)境中受體動(dòng)態(tài)調(diào)控機(jī)制的基礎(chǔ)研究提供有力工具。
清華大學(xué)藥學(xué)院杜娟娟副教授與生命科學(xué)學(xué)院李丕龍副教授為本論文的通訊作者,藥學(xué)院2019級(jí)博士生任偉帥、2020級(jí)博士生鄭培源(現(xiàn)為清華大學(xué)藥學(xué)院博士后)、2024級(jí)博士生周子婷為論文的共同第一作者。此外,已畢業(yè)博士生周敏(李丕龍課題組)、吳孟玲(杜娟娟課題組)等也為該研究作出了重要貢獻(xiàn)。清華大學(xué)實(shí)驗(yàn)儀器平臺(tái)曹慧珍老師、王瑾瑜老師、張暉老師為該研究提供了極大幫助。該研究得到了清華大學(xué)篤實(shí)計(jì)劃的資助。
Schardt, J. S.; Jhajj, H. S.; O'Meara, R. L.; Lwo, T. S.; Smith, M. D.; Tessier, P. M. Agonist antibody discovery: Experimental, computational, and rational engineering approaches. Drug Discov Today 2022, 27 (1), 31-48.
Case, L. B.; Zhang, X.; Ditlev, J. A.; Rosen, M. K. Stoichiometry controls activity of phase-separated clusters of actin signaling proteins. Science 2019, 363 (6431), 1093-1097.
Litschel, T.; Kelley, C. F.; Cheng, X.; Babl, L.; Mizuno, N.; Case, L. B.; Schwille, P. Membrane-induced 2D phase separation of the focal adhesion protein talin. Nature Communications 2024, 15 (1), 4986.
閱讀原文鏈接:https://pubs.acs.org/doi/10.1021/jacs.5c09699?sessionid=

