最新科研速遞

2025年9月18日,清華大學(xué)藥學(xué)院儲凌課題組在《Journal of the American Chemical Society》期刊發(fā)表了題為“Ligand-induced Self-Complementing tag (LiSC-tag) as an epitope tag for live-cell super-resolution imaging and functional manipulation of cellular proteins”的研究論文。本研究基于分裂FKBP F36V蛋白開發(fā)了一種新型表位標(biāo)簽LiSC-tag,實現(xiàn)了在活細(xì)胞中的超分辨成像,并可用于內(nèi)源蛋白標(biāo)記與常規(guī)成像,同時拓展到蛋白定位調(diào)控和靶向降解,為蛋白質(zhì)動態(tài)研究與功能解析提供了全新的技術(shù)工具。
超分辨顯微技術(shù)的出現(xiàn),使科研人員能夠在納米級別上觀察活細(xì)胞中的生物學(xué)過程。然而,成像標(biāo)簽始終是限制該技術(shù)進(jìn)一步發(fā)展的關(guān)鍵因素。傳統(tǒng)的方法例如抗體染色,由于抗體尺寸較大(10–15 nm),往往會引入明顯的空間偏差;熒光蛋白(FPs)和自標(biāo)記標(biāo)簽(Halo、SNAP等)雖然能在一定程度上減少偏差,但其分子量依然有20–30 kDa,仍可能影響蛋白的結(jié)構(gòu)、功能與定位,同時有些標(biāo)簽還存在光穩(wěn)定性不足的問題。相比之下,體積小巧的表位標(biāo)簽(通常僅十幾個氨基酸)因?qū)Φ鞍坠δ芨蓴_較小而備受青睞,被視為活細(xì)胞超分辨成像的理想工具。然而,現(xiàn)有表位標(biāo)簽仍存在特異性不足、信噪比偏低、細(xì)胞通透性差以及光穩(wěn)定性有限等問題,從而限制了其在活細(xì)胞研究中的廣泛應(yīng)用。
為突破這一技術(shù)瓶頸,清華大學(xué)藥學(xué)院儲凌、張數(shù)一課題組合作開發(fā)了LiSC-tag。這一全新策略將表位標(biāo)簽的緊湊特性與小分子染料的高亮度和高光穩(wěn)定性結(jié)合起來,從根本上解決了傳統(tǒng)表位標(biāo)簽信號弱、背景高的難題,為活細(xì)胞蛋白質(zhì)成像開辟了新的可能。

研究團(tuán)隊首先從分裂FKBP F36V蛋白出發(fā),設(shè)計了配體依賴的自互補系統(tǒng)。研究人員引入了噬菌體輔助非連續(xù)進(jìn)化(PANCE)方法,通過雙重正交選擇同時提升分裂片段的可溶性表達(dá)與配體依賴的三元復(fù)合物形成效率(圖2 B)。在此基礎(chǔ)上,團(tuán)隊結(jié)合結(jié)構(gòu)分析進(jìn)行關(guān)鍵氨基酸突變(圖2 F, G),并通過切割位點的系統(tǒng)優(yōu)化(圖2 H)進(jìn)一步增強了大小片段在配體誘導(dǎo)下的互補能力。經(jīng)過這一系列“三重改造”,最終獲得的LiSC-tag在可溶性表達(dá)及配體依賴的自互補效率方面均得到顯著提升,從而為其在活細(xì)胞成像中的應(yīng)用奠定了基礎(chǔ)。
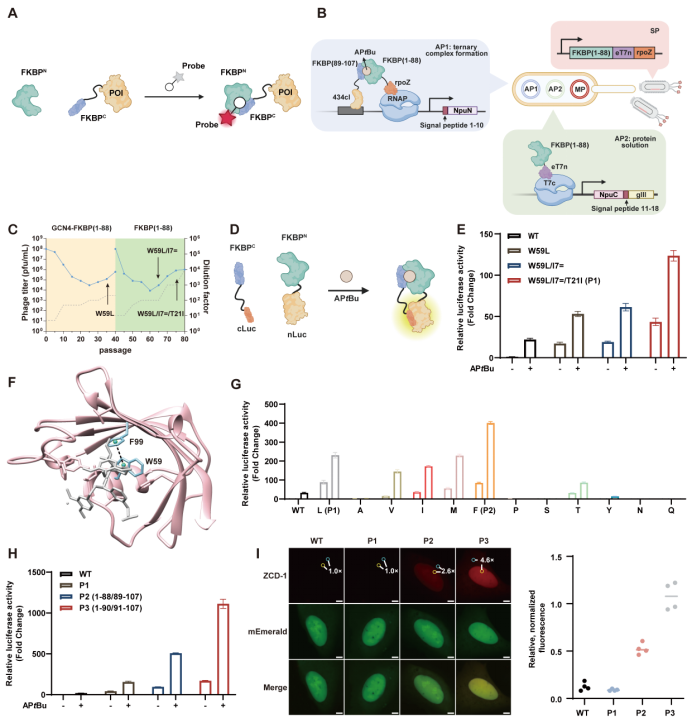
圖2. LiSC-tag的進(jìn)化以及優(yōu)化
在功能驗證中,研究人員將FKBPC小肽分別融合到Lifeact、LAMP1、mEmerald-NLS、Nup62、KRAS、Sec61β等多種蛋白上,結(jié)果均準(zhǔn)確再現(xiàn)了這些蛋白在細(xì)胞骨架、溶酶體、細(xì)胞核、核孔、細(xì)胞膜及內(nèi)質(zhì)網(wǎng)等亞細(xì)胞結(jié)構(gòu)中的分布模式(圖3 A)。進(jìn)一步實驗中,團(tuán)隊還嘗試了不同顏色的小分子探針(如ZCD-7與ZCD-8),發(fā)現(xiàn)均可實現(xiàn)清晰的熒光標(biāo)記(圖3 B),表明LiSC-tag對不同顏色探針均具有良好的兼容性,為后續(xù)開展多色成像研究奠定了基礎(chǔ)。
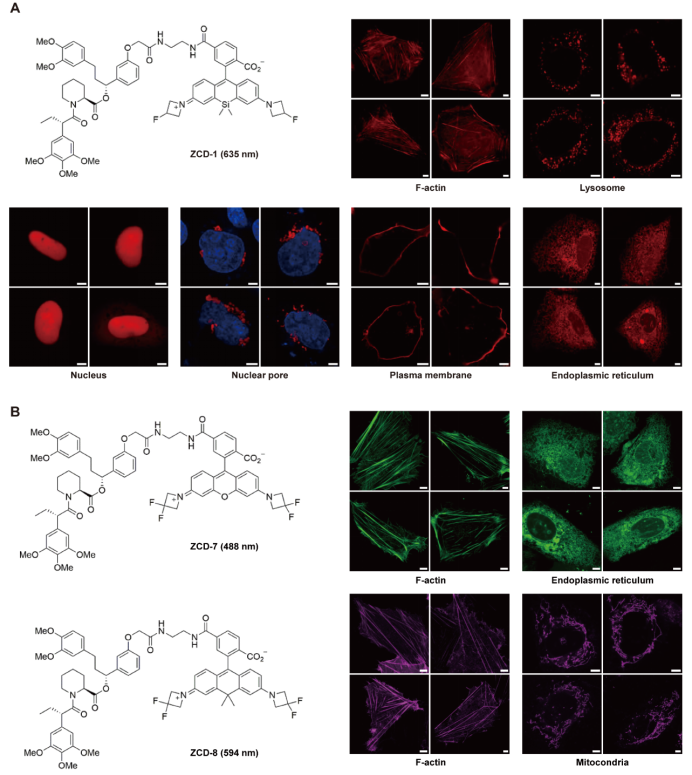
圖3 LiSC-tag在多種亞細(xì)胞結(jié)構(gòu)及多色成像中的應(yīng)用
在性能評估中,研究團(tuán)隊將LiSC-tag與現(xiàn)有的多種標(biāo)記體系進(jìn)行了系統(tǒng)比較。與split GFP和split sfCherry2相比,LiSC-tag展現(xiàn)出顯著優(yōu)勢,其熒光亮度分別提升了2.6倍和4.0倍(圖4 A, B),光漂白半衰期較split GFP延長了2.7倍(圖4 C),證明其在活細(xì)胞成像中具有更高的亮度和更強的光穩(wěn)定性。進(jìn)一步與Halo-tag和SNAP-tag的比較結(jié)果顯示,LiSC-tag的亮度接近Halo-tag,而遠(yuǎn)高于SNAP-tag(圖4 D)。這些數(shù)據(jù)表明,LiSC-tag在保持小分子量的同時,兼具與自標(biāo)記蛋白標(biāo)簽相當(dāng)?shù)墓馕锢硇阅埽晒ν黄屏藗鹘y(tǒng)小型標(biāo)簽性能不足的限制。
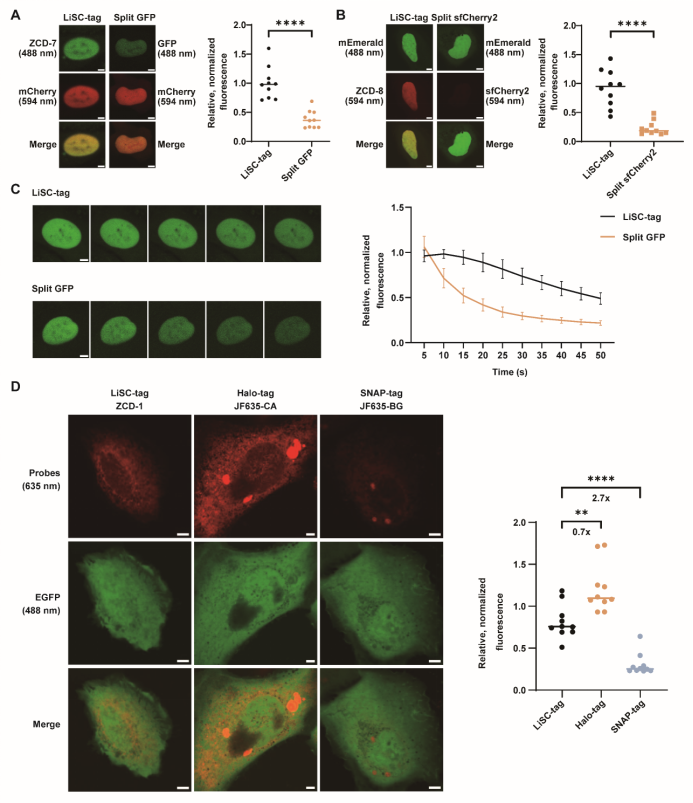
圖4 LiSC-tag與其他標(biāo)記方法的比較
在超分辨顯微實驗中,LiSC-tag展現(xiàn)出極強的適用性。在活細(xì)胞STED成像中,研究人員成功獲得了分辨率達(dá)60-70 nm的內(nèi)質(zhì)網(wǎng)圖像(圖5 A),并在長時間拍攝中依然保持了良好的抗光漂白性能(圖5 B)。在雙色STED成像實驗中,LiSC-tag與Halo-tag聯(lián)合標(biāo)記的微絲與內(nèi)質(zhì)網(wǎng)、或內(nèi)質(zhì)網(wǎng)與線粒體均被清晰區(qū)分,體現(xiàn)了其與其他標(biāo)簽的高度兼容性(圖5 C)。進(jìn)一步在STORM成像中,LiSC-tag標(biāo)記的內(nèi)質(zhì)網(wǎng)與中間絲均實現(xiàn)了約50 nm的分辨率重建,結(jié)構(gòu)細(xì)節(jié)清晰可辨(圖5 D)。最后,在活細(xì)胞SIM成像實驗中,LiSC-tag 同樣表現(xiàn)出穩(wěn)定的熒光性能,能夠精準(zhǔn)描繪微絲與微管的骨架分布。這些結(jié)果共同證明,LiSC-tag可廣泛應(yīng)用于多種超分辨技術(shù),為活細(xì)胞高分辨率成像提供了強有力的工具平臺。
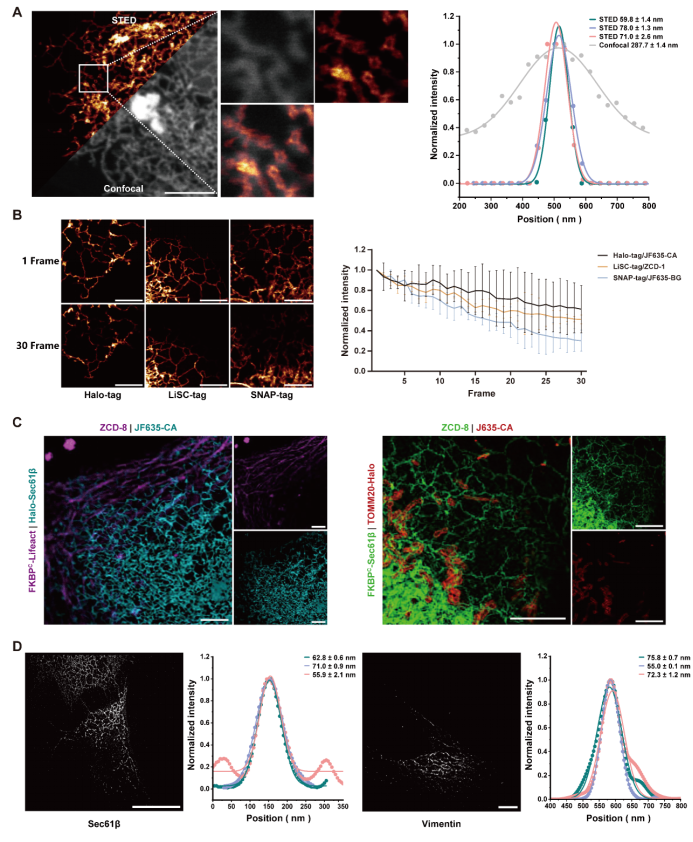
圖5 LiSC-tag在超分辨成像中的應(yīng)用
在內(nèi)源蛋白標(biāo)記實驗中,研究團(tuán)隊利用CRISPR基因編輯技術(shù),將FKBPC小肽敲入到Actin、Tubulin、Clathrin和RNA結(jié)合蛋白FUS等內(nèi)源基因中,并在活細(xì)胞中成功觀察到其天然分布模式(圖6 A-C)。相比過表達(dá)系統(tǒng),內(nèi)源標(biāo)記的蛋白在結(jié)構(gòu)保持與生理功能上更加真實。例如,在FUS蛋白的成像實驗中,過表達(dá)導(dǎo)致其核內(nèi)液滴數(shù)量與大小異常,而內(nèi)源性標(biāo)記則如實呈現(xiàn)了其自然狀態(tài)(圖6 B)。這充分說明,LiSC-tag不僅體積小、易于敲入,還能夠在不擾亂蛋白功能的前提下,實現(xiàn)對內(nèi)源性蛋白的精準(zhǔn)成像。
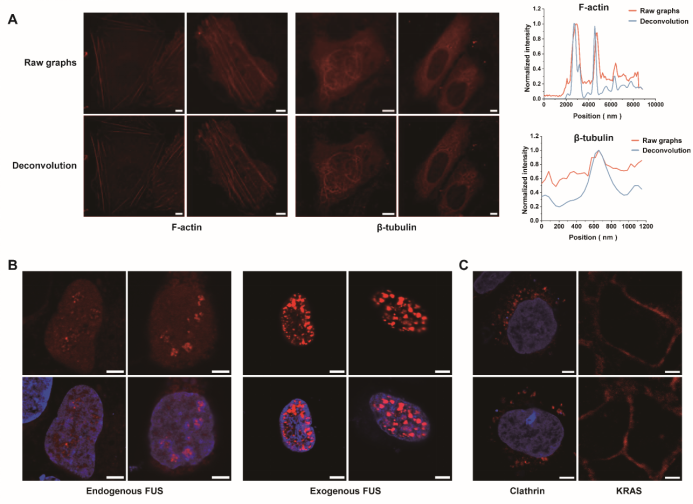
圖6 LiSC-tag對內(nèi)源蛋白的標(biāo)記與成像
更值得關(guān)注的是,LiSC-tag在蛋白功能操控方面同樣展現(xiàn)出獨特潛力。研究團(tuán)隊通過設(shè)計帶有化學(xué)連接基團(tuán)的配體,實現(xiàn)了蛋白在細(xì)胞核與細(xì)胞質(zhì)之間的可控運輸(圖7A, B),從而能夠精確調(diào)節(jié)蛋白的亞細(xì)胞定位。此外,LiSC-tag還可以與小分子降解劑dTAG-13聯(lián)合使用,用于特異性降解KRAS等關(guān)鍵蛋白。實驗結(jié)果表明,當(dāng)KRAS融合FKBPC小肽后,經(jīng)dTAG-13處理數(shù)小時即可觀察到其蛋白水平顯著下降,且該過程依賴于泛素-蛋白酶體途徑完成(圖7 C-F)。以上發(fā)現(xiàn)說明,LiSC-tag不僅是一個高效的成像工具,更是一種能夠?qū)崿F(xiàn)蛋白動態(tài)操控的多功能平臺。
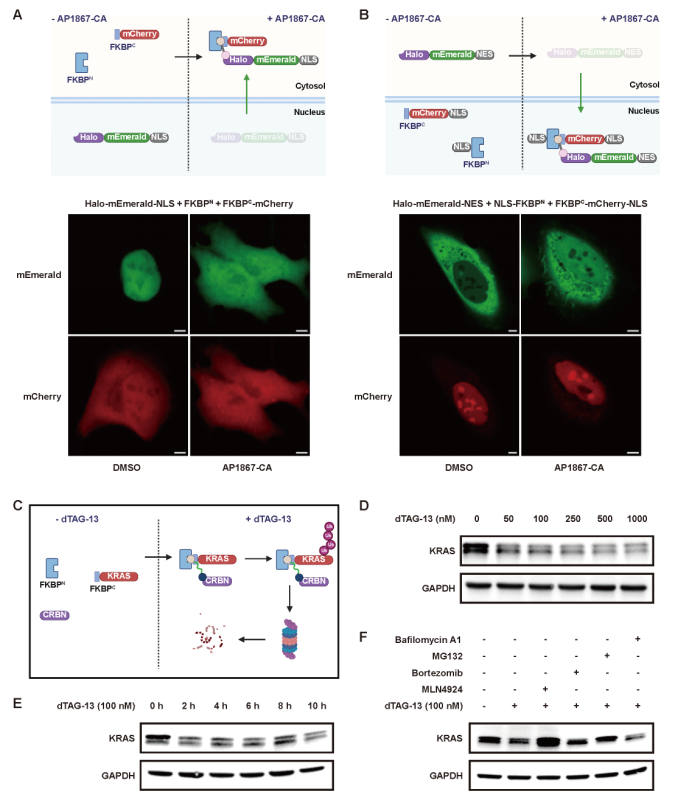
圖7 LiSC-tag在蛋白運輸與靶向降解中的應(yīng)用
綜上所述,本研究表明LiSC-tag在共聚焦及多種超分辨顯微成像模式中均表現(xiàn)出優(yōu)異性能,并在內(nèi)源蛋白標(biāo)記和蛋白功能操控方面展現(xiàn)出獨特優(yōu)勢,不僅克服了長期困擾多肽標(biāo)簽的效率與特異性難題,也為蛋白研究開辟了新的可能性。
清華大學(xué)藥學(xué)院儲凌副教授、張數(shù)一副教授為本文的共同通訊作者。儲凌課題組2019級博士生涂柳欣與張數(shù)一課題組2022級博士生秦紅為本文的共同第一作者。儲凌課題組博士生羅思遠(yuǎn)、劉曉菲,藥學(xué)院李寅青老師及博士生富晶晶、黃明磊,以及哈爾濱工業(yè)大學(xué)丁相妍老師在實驗過程中給予了重要支持。
原文鏈接:https://pubs.acs.org/doi/full/10.1021/jacs.5c07733?sessionid=

