2025年10月13日,清華大學(xué)藥學(xué)院尹航教授課題組,在國際權(quán)威學(xué)術(shù)期刊《eLife》在線發(fā)表了題為“Organelle membrane-associated proteins recruit cGAS via phase separation to facilitate its membrane localization”的研究論文。該研究首次揭示了細(xì)胞內(nèi)cGAS蛋白在應(yīng)對DNA刺激時,可以被細(xì)胞器膜上發(fā)生液-液相分離(liquid-liquidphaseseparation, LLPS)的特定蛋白招募至內(nèi)質(zhì)網(wǎng)、高爾基體和內(nèi)體膜上,從而對其先天免疫活性進行精細(xì)空間調(diào)控,為理解cGAS-STING信號通路的調(diào)節(jié)機制提供了全新視角。
天然免疫是機體抵御病原體入侵的第一道防線。當(dāng)病毒或其他病原體侵入時,其DNA會被細(xì)胞內(nèi)的DNA受體—cGAS(cyclicGMP-AMPsynthase)識別并激活,隨后通過合成第二信使cGAMP激活下游STING-TBK1-IRF3信號通路,誘導(dǎo)I型干擾素等抗病毒因子的產(chǎn)生。cGAS的定位和活性受到嚴(yán)格調(diào)控,既要及時響應(yīng)外源DNA,又要避免對自身DNA的錯誤識別而引發(fā)自身免疫疾病。因此,闡明cGAS亞細(xì)胞定位和活性調(diào)控的機制,一直是先天免疫領(lǐng)域的重要科學(xué)問題。
研究團隊通過Optiprep密度梯度離心、光電聯(lián)用顯微技術(shù)和split-sfGFP互補報告系統(tǒng)等手段,發(fā)現(xiàn)DNA刺激后,cGAS不僅存在于細(xì)胞質(zhì)中,還可以被招募至內(nèi)質(zhì)網(wǎng)、高爾基體以及內(nèi)體膜上,并在這些區(qū)域形成顯著的蛋白凝聚結(jié)構(gòu)。這一現(xiàn)象提示,細(xì)胞器膜可能在cGAS的空間定位與活性調(diào)控中扮演重要角色。
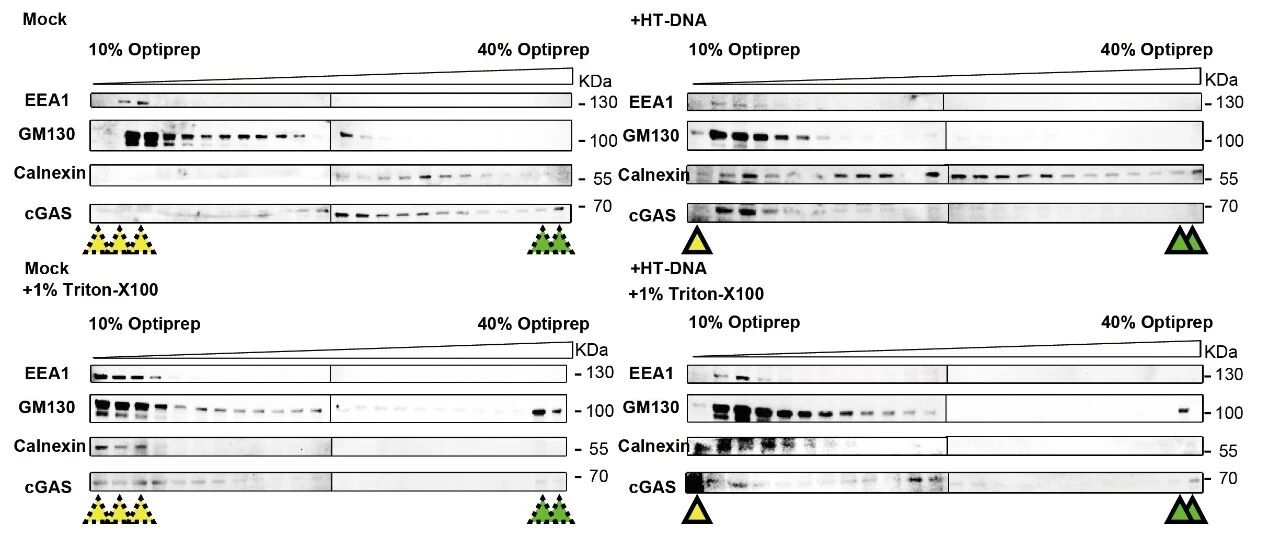
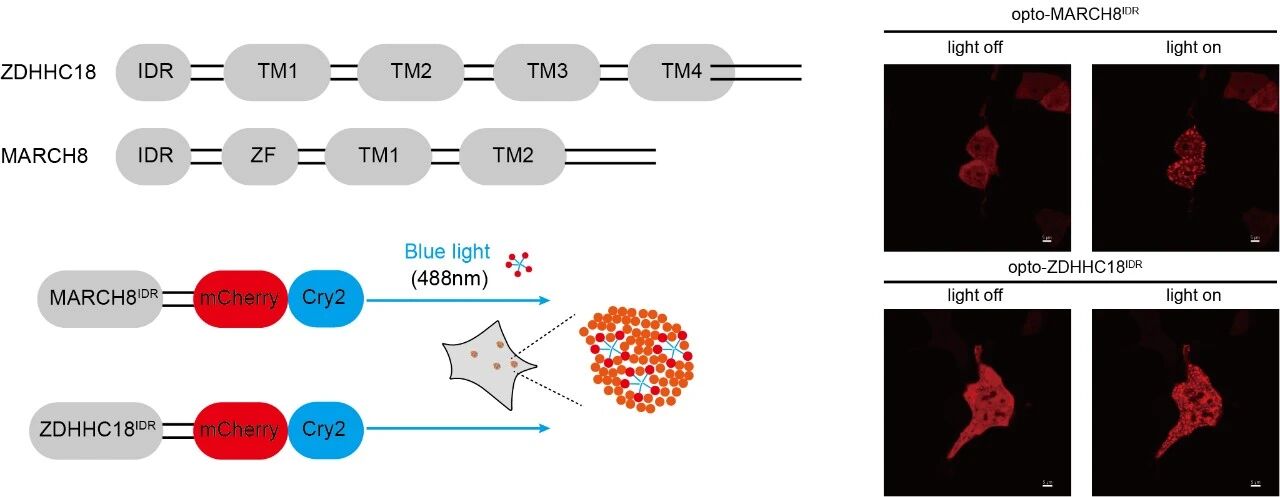
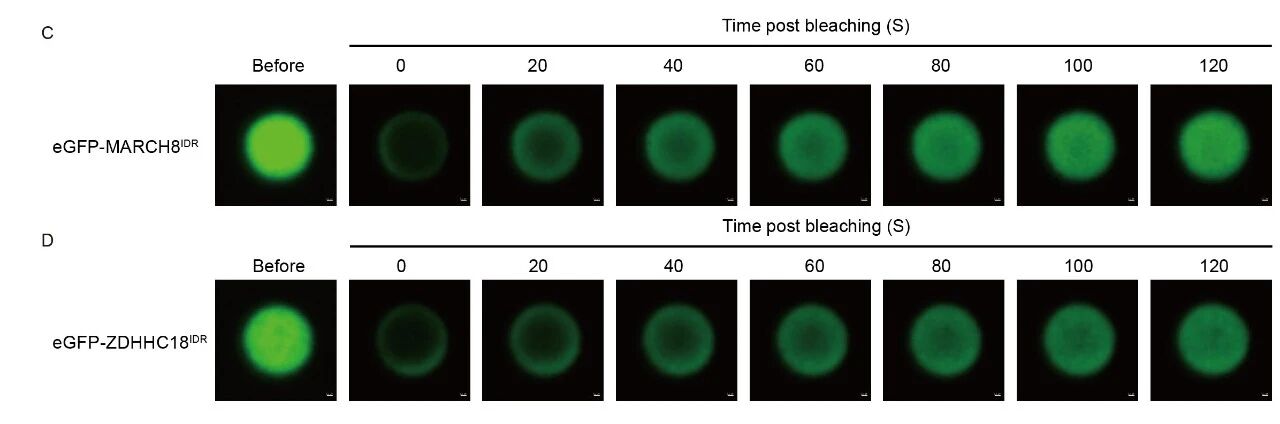
為了探究細(xì)胞器膜如何招募cGAS,作者探討了之前報道的兩種分別定位在高爾基體和內(nèi)體上的膜結(jié)合酶—ZDHHC18和MARCH8,并發(fā)現(xiàn)這兩個細(xì)胞器膜結(jié)合酶在cGAS的膜定位過程中發(fā)揮關(guān)鍵作用。這兩種酶的N端含有大量無序序列 (intrinsically disordered regions, IDRs),有助于將cGAS-DNA復(fù)合體招募至相應(yīng)的細(xì)胞器膜。作者利用光遺傳學(xué)系統(tǒng)、原位近鄰標(biāo)記(LOV-turbo)和體外重組蛋白實驗系統(tǒng),證明ZDHHC18和MARCH8的IDR可以在細(xì)胞內(nèi)和體外環(huán)境中發(fā)生液-液相分離,形成可逆、動態(tài)的液滴結(jié)構(gòu)(生物分子凝聚體)。這些凝聚體特異性地招募cGAS及其配體DNA至相應(yīng)的細(xì)胞器膜,實現(xiàn)cGAS的“空間隔離”,并進一步對cGAS進行棕櫚酰化和泛素化修飾,最終抑制cGAS的活性、防止過度免疫反應(yīng),從而實現(xiàn)對先天免疫信號的精確負(fù)調(diào)控。
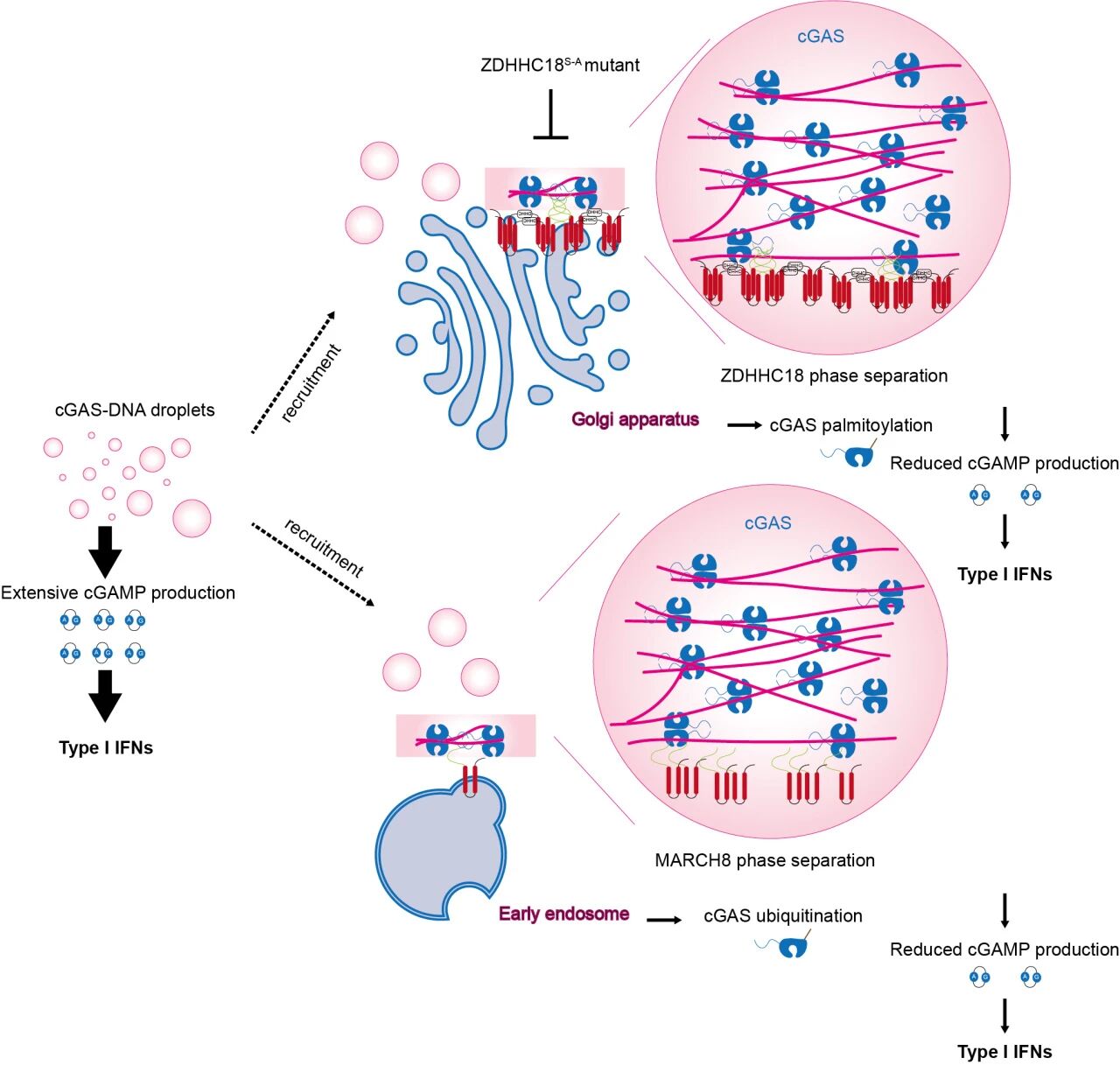
綜上,本研究提出了一個全新的調(diào)控模型:DNA激活的cGAS-DNA凝聚體可被ZDHHC18和MARCH8在細(xì)胞器膜上“捕獲”,通過相分離介導(dǎo)的空間定位和翻譯后修飾,實現(xiàn)信號強度和持續(xù)時間的微調(diào)。這一發(fā)現(xiàn)拓展了人們對cGAS活性調(diào)控的認(rèn)識,揭示了空間組織、相分離以及翻譯后修飾協(xié)同調(diào)控天然免疫信號的新機制,也為開發(fā)靶向cGAS-STING通路的免疫調(diào)節(jié)藥物提供了新的理論基礎(chǔ)。
該論文的第一作者施成瑞博士工作單位為南京鼓樓醫(yī)院。合作作者包括清華大學(xué)藥學(xué)院畢業(yè)生蘇超飛博士和在讀博士生張凱翔,通訊作者為清華大學(xué)藥學(xué)院尹航教授。本研究獲得了國家自然科學(xué)基金等項目的資助。
閱讀全文:https://elifesciences.org/reviewed-preprints/108566v1?sessionid=

