葡萄糖是人體細胞能量的主要來源,而G6P是葡萄糖代謝的“關(guān)鍵樞紐”——它不僅是糖原合成、糖酵解、磷酸戊糖途徑等關(guān)鍵代謝通路的起點,更是糖異生和糖原分解的核心中間產(chǎn)物。1947年,格蒂·科里與丈夫卡爾·科里因為發(fā)現(xiàn)“糖原的催化轉(zhuǎn)化過程”共同榮獲諾貝爾生理學或醫(yī)學獎。而糖原分解產(chǎn)生的G6P需要進入內(nèi)質(zhì)網(wǎng)由葡萄糖-6-磷酸酶催化成葡萄糖,維持葡萄糖代謝穩(wěn)態(tài),G6PT就是負責完成這一關(guān)鍵轉(zhuǎn)運。G6PT的功能異常會引發(fā)GSD-Ib、低血糖、肝腎功能損傷(肝腫大、腎腫大)、生長遲緩、高脂血癥等一系列嚴重疾病。然而,科學界對于G6PT的結(jié)構(gòu)特征、底物識別機制、轉(zhuǎn)運過程及抑制劑作用機制此前并不清楚。
2025年10月24日,清華大學藥學院陳立功團隊和中國科學院物理研究所姜道華團隊合作在Nature Communications雜志發(fā)表了題為“ Structural basis for transport and inhibition of the human glucose-6-phosphate transporter G6PT ”的最新研究成果。該研究首次解析了人源葡萄糖-6-磷酸轉(zhuǎn)運蛋白(G6PT)在空載、G6P結(jié)合及抑制劑綠原酸(CHA)結(jié)合狀態(tài)下的冷凍電鏡結(jié)構(gòu),揭示了G6P識別和轉(zhuǎn)運的分子機制,以及CHA的抑制機制,為研究相關(guān)生理過程和GSD-Ib、低血糖等疾病機制提供了關(guān)鍵結(jié)構(gòu)基礎(chǔ)。

研究團隊首先對G6PT的功能特性進行了深入研究,發(fā)現(xiàn)G6PT與葡萄糖-6-磷酸酶(G6PC1)共表達會顯著增加其轉(zhuǎn)運活性,基于這一發(fā)現(xiàn)團隊創(chuàng)新性地建立了其轉(zhuǎn)運活性測試方法。為了進一步探究其結(jié)構(gòu)基礎(chǔ),研究團隊采用ALFA標簽融合策略(將短α螺旋標簽引入G6PT),結(jié)合納米抗體(NbALFA)輔助冷凍電鏡分析,成功解析了G6PT處于外向開放狀態(tài)(G6PT-apo)、G6PT處于外向開放狀態(tài)時與G6P復合物(G6PT-G6P)和G6PT與CHA結(jié)合后處于內(nèi)向閉塞狀態(tài)(G6PT-CHA)的高分辨率冷凍電鏡結(jié)構(gòu)。

圖1 人源G6PT冷凍電鏡結(jié)構(gòu)(G6PT-apo,G6PT-G6P,G6PT-CHA)
通過結(jié)構(gòu)分析和定點突變實驗,一方面明確了G6P在轉(zhuǎn)運蛋白中的結(jié)合位點及關(guān)鍵相互作用殘基,發(fā)現(xiàn)G6PT識別G6P通過“雙亞位點”,亞位點A(磷酸識別區(qū))由TM2上的Y60、K64和TM11上的H366組成,通過極性相互作用精準結(jié)合G6P的磷酸基團,亞位點B(葡萄糖識別區(qū))由TM4上的W118、TM5上的W138和S142、TM7上的Y233等殘基構(gòu)成,通過氫鍵和范德華力固定G6P的葡萄糖部分;另一方面明確了G6PT特異性抑制劑CHA的抑制機制,揭示了其“雙重抑制策略”,CHA的奎寧酸部分競爭性占據(jù)G6P的結(jié)合位點,直接阻斷G6P與G6PT的結(jié)合,CHA的咖啡酸部分插入TM5與TM10之間,通過π-π堆積和范德華力固定G6PT的“內(nèi)向閉塞”構(gòu)象,使其無法轉(zhuǎn)換為轉(zhuǎn)運所需的開放狀態(tài),徹底終止G6P轉(zhuǎn)運。通過將GSD-Ib的臨床相關(guān)致病性突變映射到解出的三維結(jié)構(gòu)上,結(jié)合功能突變實驗明確了部分突變對蛋白構(gòu)象、底物結(jié)合或轉(zhuǎn)運過程的影響。
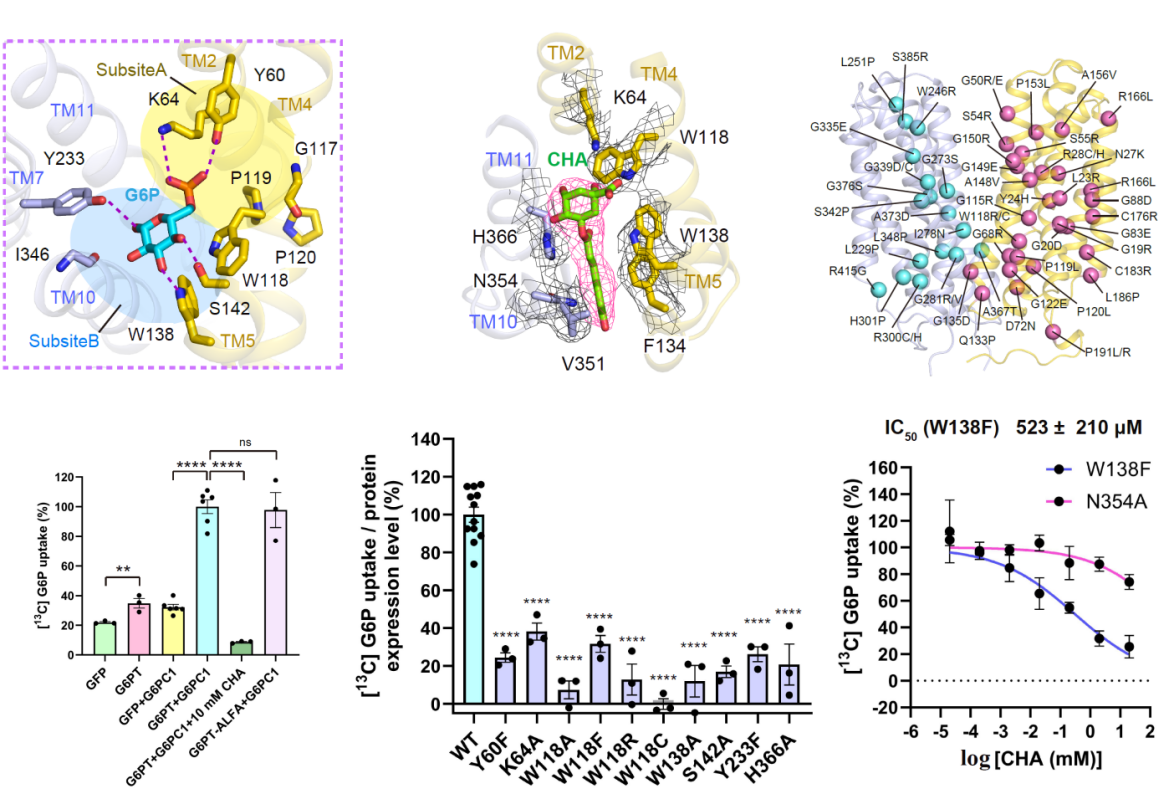
圖2 G6PT底物識別、抑制劑結(jié)合關(guān)鍵位點及致病突變位點
基于這些研究結(jié)果,團隊提出了G6PT轉(zhuǎn)運G6P及CHA抑制轉(zhuǎn)運的機制,完善了對其轉(zhuǎn)運過程的理解。
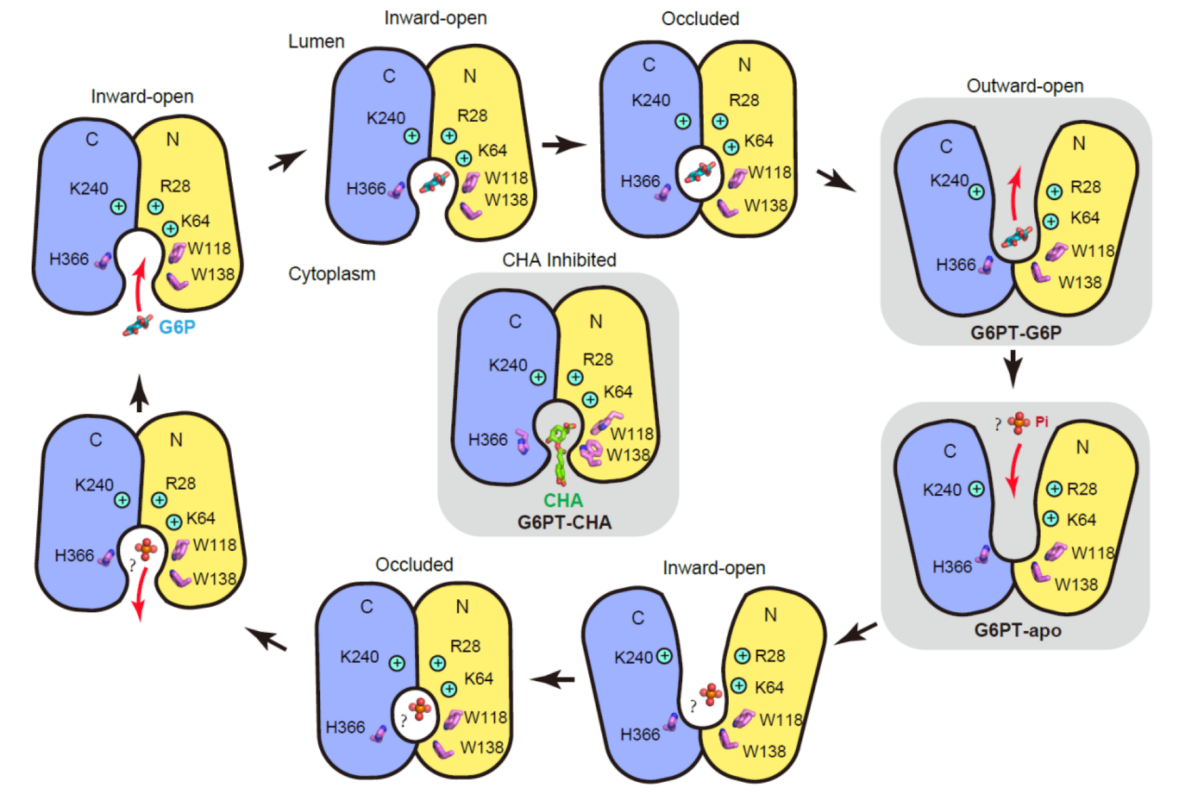
圖3 G6PT底物轉(zhuǎn)運及抑制機制示意圖
該研究揭示了人源葡萄糖-6-磷酸轉(zhuǎn)運蛋白的結(jié)構(gòu)和轉(zhuǎn)運機制,為深入理解葡萄糖-6-磷酸代謝相關(guān)生理過程和疾病發(fā)生機制提供了理論依據(jù),還為以G6PT為靶點的藥物研發(fā)開辟了新的方向,有望為相關(guān)疾病的治療帶來新的策略。
中國科學院物理研究所姜道華研究員與清華大學藥學院陳立功教授為論文共同通訊作者,中科院物理研究所博士生夏嶄憶、清華大學藥學院博士生王亞棋、中科院物理所博士后武迪及北京大學現(xiàn)代農(nóng)業(yè)研究院遲程研究員為共同第一作者,清華大學-蘇州大學聯(lián)合培養(yǎng)碩士生李琛為該課題做出重要貢獻。該研究得到國家自然科學基金、科技部國家重點研發(fā)計劃等項目資助,清華大學藥學技術(shù)中心提供了質(zhì)譜測試。
閱讀原文:https://www.nature.com/articles/s41467-025-64464-1?sessionid=

