最新科研速遞
近日,清華大學藥學院劉翔宇實驗室在《PNAS》雜志先后發(fā)表了兩項研究成果,提出了一種名為“Click Fusion”的研究策略。他們利用近年來興起的機器學習驅(qū)動的蛋白質(zhì)設(shè)計工具,深入探索了蛋白質(zhì)從頭設(shè)計在GPCR融合蛋白設(shè)計中的應用潛力,為解析非激活態(tài)GPCR結(jié)構(gòu)以及篩選GPCR新配體提供了具有廣闊應用前景的新工具。
一、G蛋白偶聯(lián)受體(GPCRs)是什么?
G蛋白偶聯(lián)受體(GPCRs)作為一類具有七次跨膜結(jié)構(gòu)的膜蛋白,是生理調(diào)控的核心元件。它們識別多樣的胞外信號,比如激素、神經(jīng)遞質(zhì)、光等,并將信號向胞內(nèi)傳遞,介導廣泛的細胞應答。正因其在疾病發(fā)生與發(fā)展中的重要作用,GPCRs被視作藥物研發(fā)的關(guān)鍵靶點。這一重要性在臨床用藥中得到印證:據(jù)統(tǒng)計,約34%的FDA批準藥物以GPCR為靶點;在這些藥物中,拮抗劑占比過半,激動劑占比超過四成。
二、為什么非激活態(tài)GPCR結(jié)構(gòu)解析很困難?
結(jié)構(gòu)生物學是揭示分子藥理機制與指導藥物設(shè)計的關(guān)鍵手段。然而,在GPCR研究中,解析其非激活態(tài)的冷凍電鏡結(jié)構(gòu)仍是一大技術(shù)瓶頸。這與結(jié)合G蛋白的激活態(tài)GPCR結(jié)構(gòu)研究中形成鮮明對比:在冷凍電鏡下,這種90-150 kDa的GPCR-G蛋白復合物因其具有G蛋白這一可溶性“信號源”,為顆粒對齊提供了穩(wěn)定特征,因而更易于解析。相反,拮抗劑結(jié)合的GPCR(尤其分子量僅37-50 kDa的A類受體)結(jié)構(gòu)解析則困難得多,它們因缺乏額外的可溶結(jié)構(gòu)域,如同一個難以捕捉的微小目標,給結(jié)構(gòu)解析帶來了巨大挑戰(zhàn)。應對這一挑戰(zhàn)的關(guān)鍵在于引入不被去垢劑膠束包裹的結(jié)構(gòu)域作為顆粒對齊的特征,例如引入納米抗體或融合蛋白。自2007年Brian Kobilka團隊利用融合T4L蛋白獲得第一個人源GPCR結(jié)構(gòu)以來,融合蛋白已成為GPCR結(jié)構(gòu)研究的重要工具。隨后,Aashish Manglik團隊與程亦凡團隊驗證了BRIL/PGS等融合蛋白在冷凍電鏡結(jié)構(gòu)解析中的可行性。他們同時指出,在目標受體與融合蛋白之間形成剛性連接,從而使受體與融合蛋白的相對位置保持一致,是幫助結(jié)構(gòu)解析的關(guān)鍵。進一步地,陶余勇團隊、胡紅麗團隊以及徐俊等人開發(fā)了多種融合蛋白策略,在非激活態(tài)GPCR的冷凍電鏡結(jié)構(gòu)解析中驗證了效果。然而,這些方法依賴于對蛋白融合位點的生化篩選,工作量較大。
三、 GPCR配體篩選的難點是什么?
GPCR配體篩選面臨的主要挑戰(zhàn)之一源于該受體家族的高度動態(tài)性。由于GPCR在非活性和活性狀態(tài)之間存在構(gòu)象動態(tài)平衡,其結(jié)構(gòu)靈活性使得直接篩選并富集針對某一特定構(gòu)象的配體變得尤為復雜。目前一些基于結(jié)合實驗的篩選技術(shù),如DNA編碼化合物庫、酵母表面展示庫和噬菌體展示庫,已經(jīng)在探索GPCR配體的化學空間及實現(xiàn)構(gòu)象選擇方面展現(xiàn)出潛力。但是這些方法成功的關(guān)鍵在于獲得構(gòu)象穩(wěn)定的高純度受體。而獲得固定構(gòu)象,尤其是激活態(tài)構(gòu)象的受體并不容易。目前常用的制備激活態(tài)受體的策略包括引入完全激動劑、G蛋白或其模擬物來進行構(gòu)象穩(wěn)定。這些方法雖有一定效果,卻存在明顯局限:完全激動劑會占據(jù)正構(gòu)配體結(jié)合口袋,從而阻礙其他正構(gòu)激動劑的篩選;同時,現(xiàn)有策略制備的受體-G蛋白復合物往往穩(wěn)定性不足,在實驗過程中易發(fā)生解離,影響篩選的準確性與效率。因此開發(fā)具有穩(wěn)定構(gòu)象(尤其是激活態(tài)構(gòu)象)的工程化受體,以破解相關(guān)研究瓶頸,已成為GPCR藥物篩選領(lǐng)域的迫切需求。
四、 如何設(shè)計融合蛋白?
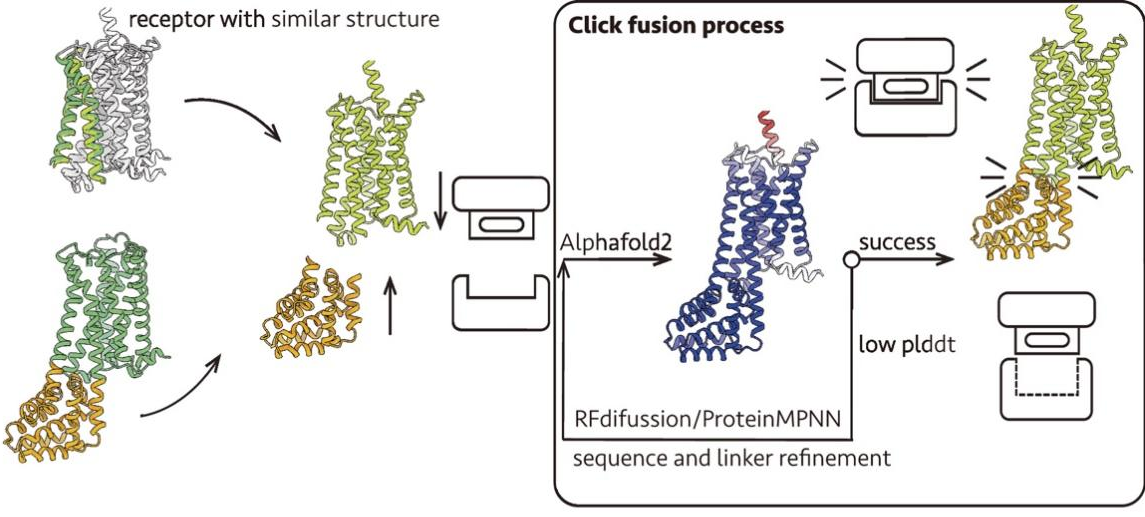
研究團隊將AI驅(qū)動的蛋白質(zhì)設(shè)計技術(shù)應用于融合蛋白設(shè)計,研發(fā)出一種名為“Click Fusion”(點擊融合)的新策略。該命名具有雙重含義:一方面,蛋白質(zhì)工程設(shè)計過程高度依賴計算機設(shè)計,只需輕點鼠標即可完成,無需進行大量實驗篩選;另一方面,融合蛋白能夠像匹配的卡扣一樣“咔嗒”一聲精準結(jié)合,實現(xiàn)無縫轉(zhuǎn)移。基于這一策略,研究團隊成功設(shè)計出分別將GPCR穩(wěn)定在激活態(tài)與非激活態(tài)的融合蛋白。其設(shè)計思路源于對GPCR激活過程中關(guān)鍵構(gòu)象變化的把握,即調(diào)控第六跨膜螺旋TM6的擺動。通過將TM6穩(wěn)定在“內(nèi)收”或“外擺”的位置,可相應地將受體穩(wěn)定于非激活態(tài)或激活態(tài)(圖1 A)。
圖1:融合蛋白設(shè)計 (A)設(shè)計融合蛋白穩(wěn)定GPCR的非激活態(tài)和激活態(tài)構(gòu)象 (B)GPCR穩(wěn)定在非激活態(tài)的M1R-Clip設(shè)計流程 (C)GPCR穩(wěn)定在激活態(tài)的M1R-G11CT設(shè)計流程 (D)M1R-Clip1的冷凍電鏡結(jié)構(gòu) (E)M1R-G11CT的冷凍電鏡結(jié)構(gòu)
?將GPCR穩(wěn)定在非激活態(tài)的融合蛋白設(shè)計?
設(shè)計流程如圖所示,分為以下幾個關(guān)鍵步驟:1. 融合位點選擇:基于 GPCR 結(jié)構(gòu)模型(來自 AlphaFold2 預測或 GPCRdb 數(shù)據(jù)庫),刪除細胞內(nèi)環(huán) 3(ICL3),并確定 TM5 和 TM6 的連接殘基作為融合位點;2. 骨架生成:使用 RFdiffusion 方法分三步生成融合蛋白骨架,包括延伸 TM5 和 TM6 的螺旋段、在延伸區(qū)域插入穩(wěn)定的中間螺旋作為結(jié)構(gòu)支撐,以及生成完整的 Clip 蛋白骨架(長度約 100–150 個氨基酸);3. 序列優(yōu)化與結(jié)構(gòu)預測:使用 ProteinMPNN 進行側(cè)鏈生成和序列優(yōu)化,采用 AlphaFold2 或 ESMFold 對融合構(gòu)建體進行結(jié)構(gòu)預測,并以 pLDDT 分數(shù)評估結(jié)構(gòu)可信度和連接區(qū)域的剛性,對低評分區(qū)域再次利用 RFdiffusion 優(yōu)化骨架結(jié)構(gòu);4. 實驗驗證準備:選擇高 pLDDT 分數(shù)的設(shè)計方案,合成編碼 DNA,在細胞中表達、純化以獲得 GPCR-Clip 蛋白,進行后續(xù)生化與結(jié)構(gòu)驗證(圖1 B)。
?將GPCR穩(wěn)定在激活態(tài)的融合蛋白設(shè)計?
設(shè)計原理基于激活態(tài)GPCR的結(jié)構(gòu)基礎(chǔ)。G蛋白的α5螺旋被保留下來用于鎖定TM6結(jié)構(gòu)域向外移動的構(gòu)象。前期研究表明,僅α5螺旋即可穩(wěn)定β2-腎上腺素受體的活性狀態(tài)。基于這些研究基礎(chǔ),穩(wěn)定激活態(tài)受體的融合蛋白設(shè)計流程與非激活態(tài)融合蛋白的設(shè)計流程基本一致,但進行了獨特的改進。其流程分為以下幾個關(guān)鍵步驟:1. 輸入結(jié)構(gòu)準備:基于GPCR-G蛋白復合物結(jié)構(gòu),保留完整的受體和G蛋白的α5螺旋;2. 融合蛋白生成:使用RFdiffusion生成融合蛋白的骨架,使其環(huán)繞包圍整個α5螺旋,并使用ProteinMPNN進行側(cè)鏈生成和序列優(yōu)化,同時使用AlphaFold2-multimer進行結(jié)構(gòu)預測;3. 構(gòu)造設(shè)計:在TM5和TM6之間插入融合蛋白的同時,將α5螺旋通過2×GGSGG的連接序列融合到受體的C末端(圖1 C)。
五、 M1R-Clip1和M1R-G11CT的生化驗證
為驗證Click Fusion策略的可行性,研究團隊首先選擇了M1型毒蕈堿乙酰膽堿受體(M1R)作為模式受體。研究團隊分別設(shè)計了穩(wěn)定在非激活態(tài)的M1R-Clip1蛋白和穩(wěn)定在激活態(tài)的M1R-G11CT蛋白。M1R-Clip1和M1R-G11CT都能在昆蟲細胞中表達,并且其表達量相較于野生型的M1R有明顯提高。在配體競爭結(jié)合實驗中,M1R-Clip1 對拮抗劑 atropine 和激動劑iperoxo的結(jié)合能力與野生型 M1R 基本一致,表明其保留了原有藥理特性。M1R-G11CT對激動劑iperoxo的結(jié)合能力相對于野生型的M1R提升了近三個數(shù)量級,且形成一個擬合良好的單相曲線,表明了M1R-G11CT被穩(wěn)定在均一的激活態(tài)。
隨后,研究團隊成功解析了M1R-Clip1與M1R-G11CT的冷凍電鏡結(jié)構(gòu)。在二維分類圖像中,可清晰觀察到融合蛋白的特征信號,這表明該信號在顆粒對齊過程中起到了關(guān)鍵作用。最終獲得的三維結(jié)構(gòu)不僅與AlphaFold2的預測模型高度一致,其整體構(gòu)象和配體結(jié)合位點也與已報道的結(jié)構(gòu)無明顯差異。更重要的是,結(jié)構(gòu)分析明確顯示,M1R-Clip1處于非激活狀態(tài),而M1R-G11CT則被穩(wěn)定在激活狀態(tài)(圖1 D、E)。
六、融合蛋白輔助非激活態(tài)GPCR結(jié)構(gòu)解析
活態(tài)GPCR結(jié)構(gòu)解析長期受困于兩大痛點:缺乏有效的對齊標記與受體構(gòu)象不穩(wěn)定。Clip的設(shè)計既為冷凍電鏡提供了剛性對齊特征,又將受體牢牢錨定在非激活態(tài)。M1R-Clip1結(jié)構(gòu)的成功解析便是此策略可行的首個證明。
為驗證本方法的普適性。研究團隊選擇了神經(jīng)調(diào)節(jié)素B受體(NMBR)——一個缺乏非激活態(tài)結(jié)構(gòu)的受體作為試金石。最終,憑借NMBR-Clip2構(gòu)建體,團隊成功解析了NMBR的三維結(jié)構(gòu)(分辨率3.4 ?),并揭示了NMBR的活性調(diào)節(jié)機制。結(jié)構(gòu)清晰地顯示,當內(nèi)源性激動劑NMB深入結(jié)合口袋時,其末端的甲硫氨酸會與“開關(guān)殘基”產(chǎn)生相互作用,觸發(fā)了開關(guān)的下移,從而觸發(fā)了受體的激活。而拮抗劑不會觸碰到該“開關(guān)殘基”,不會引起受體的激活。
七、 融合蛋白輔助GPCR的胞外納米抗體篩選
基于Click Fusion策略,研究團隊開發(fā)了一種篩選GPCR胞外納米抗體的新方法。該方法利用序列生成模型,構(gòu)建出一組骨架相同但序列各異的融合蛋白。這些融合蛋白幫助生成一組被稱為“胞內(nèi)正交受體”的工具受體蛋白,其胞外區(qū)域完全一致,而胞內(nèi)性質(zhì)各不相同。利用它們進行交叉篩選,可避免抗體在胞內(nèi)區(qū)域的非特異性富集,從而實現(xiàn)對胞外納米抗體的精準篩選。以M1R為模型,研究者成功篩選到特異性識別激活態(tài)與非激活態(tài)受體的胞外納米抗體,其功能實驗進一步證實了它們具有別構(gòu)調(diào)節(jié)活性。該胞內(nèi)正交篩選法為GPCR功能性納米抗體的開發(fā)提供了通用解決方案,在藥物研發(fā)中具有應用潛力(圖2)。
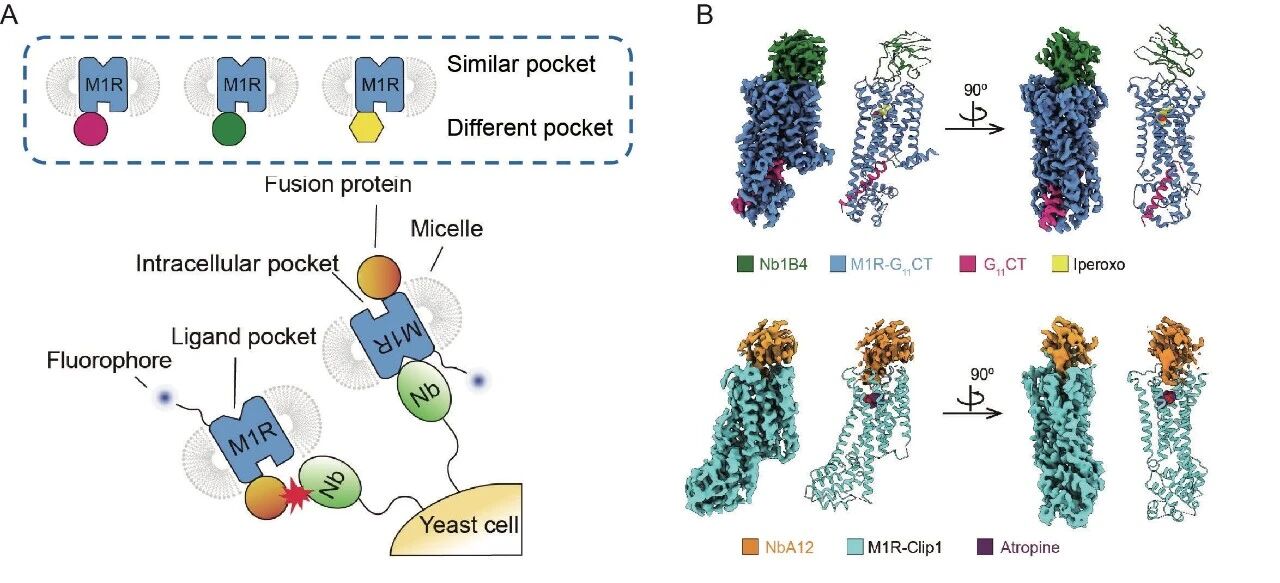
圖2:GPCR胞外納米抗體篩選 (A)胞內(nèi)正交篩選策略 (B)本工作篩選得到的構(gòu)象選擇性納米抗體與M1R受體的冷凍電鏡結(jié)構(gòu)
八、 即插即用、快速遷移
融合蛋白的快速遷移性是Click Fusion策略得以廣泛應用的根本。得益于GPCR家族高度的結(jié)構(gòu)相似性,研究團隊選取5-HT2BR為模型,通過結(jié)構(gòu)比對確定融合位點,成功將M1R-Clip1上的融合蛋白遷移至5-HT2BR,構(gòu)建了5-HT2BR-Clip1蛋白。他們進一步解析了拮抗劑Balovaptan與5-HT2BR的復合物結(jié)構(gòu),揭示了其相互作用的分子機制,從而證實了Clip在輔助GPCR非激活態(tài)結(jié)構(gòu)解析中的通用性。此外,團隊還成功構(gòu)建了α1A-GqCT、μOR-GiCT等一系列穩(wěn)定于激活態(tài)的受體。放射性同位素結(jié)合實驗表明,這些受體對各自激動劑的親和力均顯著提升。這些工作為篩選具有特定功能的GPCR配體提供了極具吸引力的技術(shù)平臺(圖3)。
清華大學藥學院劉翔宇副教授為這兩篇文章的(共同)通訊作者,中南大學湘雅醫(yī)院婦產(chǎn)科張衛(wèi)社教授為第一篇文章的共同通訊作者。清華大學藥學院已畢業(yè)博士生高凱旋,2021級博士生張欣,中南大學湘雅醫(yī)院已畢業(yè)博士生聶佳為共同第一作者。清華大學藥學院田博學副教授、醫(yī)學院博士后趙佳偉(已出站)為課題提供了重要指導。本研究受到國家自然科學基金、北京生物結(jié)構(gòu)前沿研究中心、清華北大生命科學聯(lián)合中心、清華大學篤實計劃等支持。國家蛋白質(zhì)科學中心(北京)清華大學分中心冷凍電鏡平臺,清華大學生物醫(yī)學分析中心同位素室、流式細胞儀機組為本研究提供了技術(shù)支持。
原文鏈接:https://www.pnas.org/doi/abs/10.1073/pnas.2422360122
https://www.pnas.org/doi/10.1073/pnas.2508879122

