2025年11月7日清華大學(xué)藥學(xué)院蒯銳課題組在Advanced Science發(fā)表題為“Designer solid self-emulsifying nanovaccines enable dual modulation of dendritic cells and T cells for potent antitumor immunity”的文章。該研究構(gòu)建了一種固體自乳化納米疫苗,揭示了該疫苗可通過雙向調(diào)控樹突狀細胞(DC)和 T細胞的激活增強抗腫瘤免疫應(yīng)答,初步建立了將該疫苗用于腫瘤治療的方法。
多肽疫苗因其安全性好、穩(wěn)定性高、易于合成等優(yōu)勢,在腫瘤等重大疾病的治療中極具應(yīng)用潛力。然而,皮下或肌肉注射后多肽疫苗的快速清除特性限制了其激活抗腫瘤T細胞應(yīng)答和抑制腫瘤生長的能力。基于乳劑(如Montanide)的多肽疫苗通過在注射位點形成抗原儲庫,延緩抗原清除并招募免疫細胞,從而增強免疫反應(yīng)。然而,這種招募可能導(dǎo)致 T細胞在抗原富集的環(huán)境中因缺乏有效的共刺激信號而發(fā)生凋亡。因此,現(xiàn)代疫苗設(shè)計通常會將抗原與其他免疫刺激劑,如Toll樣受體(TLR) 激動劑聯(lián)用,以規(guī)避這一風(fēng)險并協(xié)同增強免疫效果。盡管多種基于納米顆粒的疫苗能增加多肽抗原和TLR激動劑向淋巴結(jié)的輸送,促進淋巴結(jié)內(nèi)的DC吞噬疫苗并將相關(guān)信號傳遞給 T細胞以引發(fā) T細胞應(yīng)答,但納米顆粒在體內(nèi)的轉(zhuǎn)運機制及納米顆粒是否同時調(diào)控DC與T細胞尚不完全清楚,這在很大程度上制約了更加安全有效的多肽疫苗的開發(fā)。
基于以上背景,蒯銳課題組構(gòu)建了一種粒徑約為20納米、表面性質(zhì)連續(xù)可調(diào)的固體自乳化納米疫苗(Solid Self-emulsifying nanovaccines, SSE),SSE由水包油載體、疏水修飾的腫瘤抗原肽和TLR9激動劑CpG構(gòu)成。SSE疫苗可在凍干狀態(tài)長期存放,水化后可快速形成粒徑均一的納米顆粒。優(yōu)選的SSE在淋巴結(jié)的蓄積效率比Montanide乳劑、AS03乳劑、脂質(zhì)體分別高181.9、13.9、2.4倍,比傳統(tǒng)的未經(jīng)固體化工藝制備的200納米左右的自微乳(Self-emulsifying nanovaccines, SE)高2倍。研究人員使用多種不同的多肽抗原均證實SSE疫苗引發(fā)的腫瘤抗原特異性T細胞應(yīng)答也遠高于使用基于Montanide乳劑、AS03乳劑、脂質(zhì)體、SE的疫苗。機制研究發(fā)現(xiàn),SSE表面結(jié)合的載脂蛋白E(ApoE)對疫苗在淋巴結(jié)蓄積和免疫細胞吞噬方面至關(guān)重要。敲除小鼠體內(nèi)的ApoE顯著削弱了SSE疫苗在淋巴結(jié)的積累并降低抗原特異性T細胞應(yīng)答。由于低密度脂蛋白受體(LDLR)是ApoE的受體,研究人員進一步敲除小鼠體內(nèi)的LDLR,結(jié)果觀察到與ApoE敲除小鼠一致的表型,表明SSE疫苗的遞送過程依賴于ApoE-LDLR軸。另一方面,研究團隊觀察到SSE表現(xiàn)出較高的被T細胞內(nèi)吞能力,提示SSE可能具備直接調(diào)控T細胞的潛力。實驗表明,SSE的組分角鯊烯可增加 T細胞膜上膽固醇含量,促進脂筏形成,進一步增強脂筏上T細胞受體(TCR)相關(guān)信號蛋白的磷酸化,最終增敏 T細胞激活。使用角鯊烯氧化酶抑制劑可干擾SSE增強 T細胞激活的效果,在小鼠體內(nèi)條件性敲除T細胞的角鯊烯氧化酶削弱了接種SSE疫苗的小鼠產(chǎn)生抗原特異性T細胞的能力。以上結(jié)果表明SSE疫苗除了依賴傳統(tǒng)方式通過調(diào)控DC促進T細胞激活外,還直接作用于T細胞增敏其激活效果。這種讓DC和T細胞“雙向奔赴”增強抗腫瘤免疫應(yīng)答的疫苗在多種腫瘤模型上均有效抑制腫瘤生長,并保護治愈小鼠免于復(fù)發(fā)。
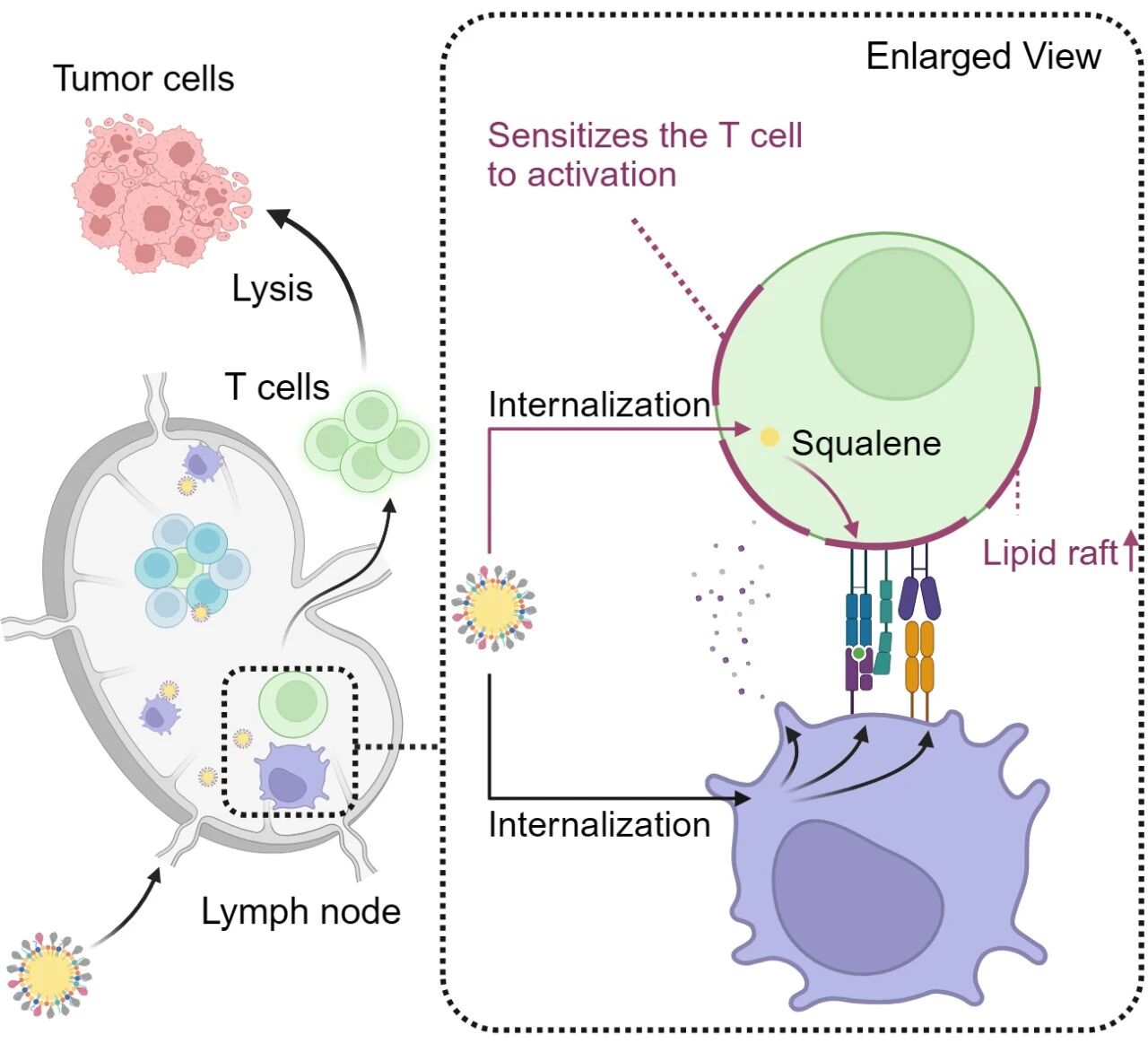
圖1:固體自乳化納米疫苗通過對樹突狀細胞和T細胞的雙向調(diào)控增強抗腫瘤免疫應(yīng)答的示意圖。
該研究報道了一種誘導(dǎo)強效抗原特異性T細胞應(yīng)答的固體化自乳化納米疫苗;闡明了該疫苗依賴表面吸附的蛋白冠組分ApoE提高淋巴結(jié)蓄積,同時通過對DC和T細胞的雙向調(diào)控并產(chǎn)生強大的抗腫瘤T細胞應(yīng)答和抗腫瘤效果,為未來腫瘤疫苗的研究提供新的思路。
清華大學(xué)藥學(xué)院蒯銳研究員為本文的通訊作者。蒯銳課題組已出站博士后沈雪瑩為本文的第一作者。蒯銳課題組博士生凡詩琦、吳程程、楊凱如,已畢業(yè)博士生何嘉、羅嵐清,已出站博士后李君耀,中山大學(xué)腫瘤防治中心夏小俊為本課題的開展提供了大量幫助。本課題得到了國家高層次人才計劃青年項目、國家自然科學(xué)基金、清華-北大生命科學(xué)聯(lián)合中心、清華大學(xué)前沿交叉專項、篤實專項等基金支持。
論文鏈接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202512139

