鐵是維持腦發(fā)育和神經(jīng)功能不可或缺的微量元素,其穩(wěn)態(tài)平衡精細(xì)而脆弱——既驅(qū)動神經(jīng)發(fā)生、突觸形成和髓鞘化等關(guān)鍵過程,又在過量時如“雙刃劍”般催生活性氧(ROS)積累,誘發(fā)氧化應(yīng)激,損害神經(jīng)干細(xì)胞更新與突觸可塑性,最終危及認(rèn)知記憶功能。SLC22A17是維持腦內(nèi)鐵穩(wěn)態(tài)的關(guān)鍵轉(zhuǎn)運蛋白,直接參與鐵的跨膜轉(zhuǎn)運與氧化應(yīng)激反應(yīng)的調(diào)控。它最初被鑒定為脂質(zhì)運載蛋白lipocalin-2(LCN2)的受體,能夠識別并結(jié)合不同鐵負(fù)載狀態(tài)的LCN2,從而精確調(diào)節(jié)細(xì)胞內(nèi)外的鐵流動。然而,盡管SLC22A17在中樞神經(jīng)系統(tǒng)中廣泛表達(dá),科學(xué)界對于SLC22A17在腦內(nèi)發(fā)揮的生理功能,以及維持鐵穩(wěn)態(tài)的具體機(jī)制尚不清楚。
2025年12月15日,清華大學(xué)藥學(xué)院陳立功團(tuán)隊在Nature Communications《自然通訊》雜志發(fā)表了題為“Slc22a17 governs postnatal neurogenesis by maintaining the iron homeostasis in hippocampus”(Slc22a17 基因通過維持海馬區(qū)鐵穩(wěn)態(tài)調(diào)控出生后神經(jīng)發(fā)生)的最新研究成果。本研究首次揭示了SLC22A17通過調(diào)控海馬神經(jīng)干細(xì)胞內(nèi)的鐵穩(wěn)態(tài)在腦發(fā)育期及成年神經(jīng)發(fā)生中發(fā)揮關(guān)鍵作用,提出了其與自噬接頭蛋白SQSTM1/p62互作,調(diào)節(jié)Nrf2/HO-1信號通路、維持氧化還原平衡的分子機(jī)制,為理解鐵代謝失衡導(dǎo)致的神經(jīng)發(fā)育障礙及相關(guān)神經(jīng)退行性疾病的防治提供了新的理論依據(jù)與潛在治療靶點。
在該研究中,轉(zhuǎn)錄組結(jié)果顯示Slc22a17是海馬中表達(dá)最豐富的鐵轉(zhuǎn)運蛋白之一。作者發(fā)現(xiàn)在胚胎第14天至出生后第14天這一關(guān)鍵發(fā)育窗口期,神經(jīng)前體細(xì)胞內(nèi)鐵含量呈現(xiàn)先升后降的動態(tài)變化,與Slc22a17的表達(dá)水平呈負(fù)相關(guān),提示Slc22a17在早期神經(jīng)發(fā)生過程中調(diào)控神經(jīng)干細(xì)胞鐵穩(wěn)態(tài)的可能性。為了探索Slc22a17在中樞神經(jīng)系統(tǒng)中的功能,作者構(gòu)建了Nestin-Cre介導(dǎo)的Slc22a17條件性敲除小鼠,系統(tǒng)地探究其在神經(jīng)發(fā)育中的作用與機(jī)制。研究發(fā)現(xiàn),Slc22a17缺失導(dǎo)致小鼠嚴(yán)重的生長發(fā)育遲緩和高死亡率,并顯著損傷海馬神經(jīng)干細(xì)胞的增殖與分化能力。進(jìn)一步研究發(fā)現(xiàn),Slc22a17不僅對發(fā)育期神經(jīng)發(fā)生至關(guān)重要,也在成年神經(jīng)發(fā)生中發(fā)揮核心作用,Nestin-CreERT2介導(dǎo)的成年誘導(dǎo)型敲除小鼠在學(xué)習(xí)與空間記憶行為學(xué)中表現(xiàn)出明顯缺陷。
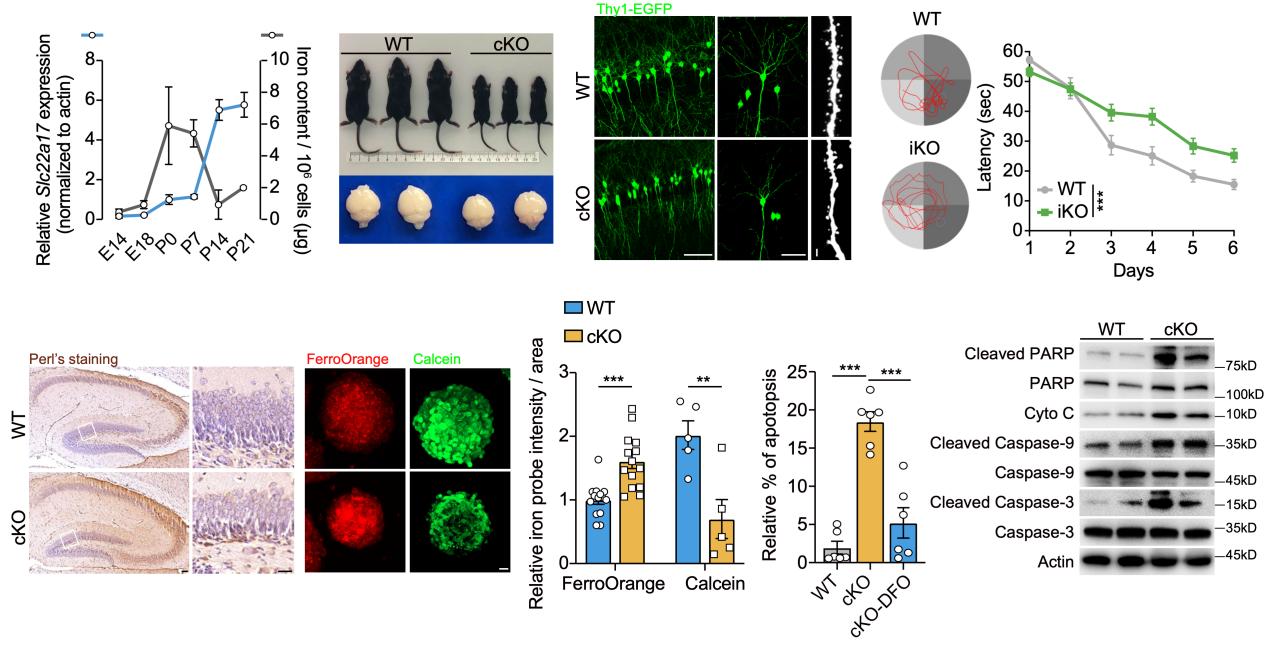
圖1 Slc22a17缺失導(dǎo)致神經(jīng)干細(xì)胞內(nèi)鐵累積,嚴(yán)重抑制神經(jīng)發(fā)生并引起早期死亡
為了解析Slc22a17缺失導(dǎo)致神經(jīng)發(fā)生受損的分子機(jī)制,作者采用電感耦合等離子體質(zhì)譜(ICP-MS)、普魯士藍(lán)染色(Perl’s staining)以及鐵熒光探針檢測等多種手段,系統(tǒng)分析了不同組織及神經(jīng)干細(xì)胞中的金屬離子分布和鐵轉(zhuǎn)運狀態(tài)。結(jié)果表明,Slc22a17缺失導(dǎo)致海馬及神經(jīng)干細(xì)胞內(nèi)的鐵顯著累積,鐵蛋白水平升高,鐵流出途徑受阻;這一鐵穩(wěn)態(tài)紊亂進(jìn)一步誘發(fā)活性氧(ROS)過量、線粒體損傷及細(xì)胞凋亡。
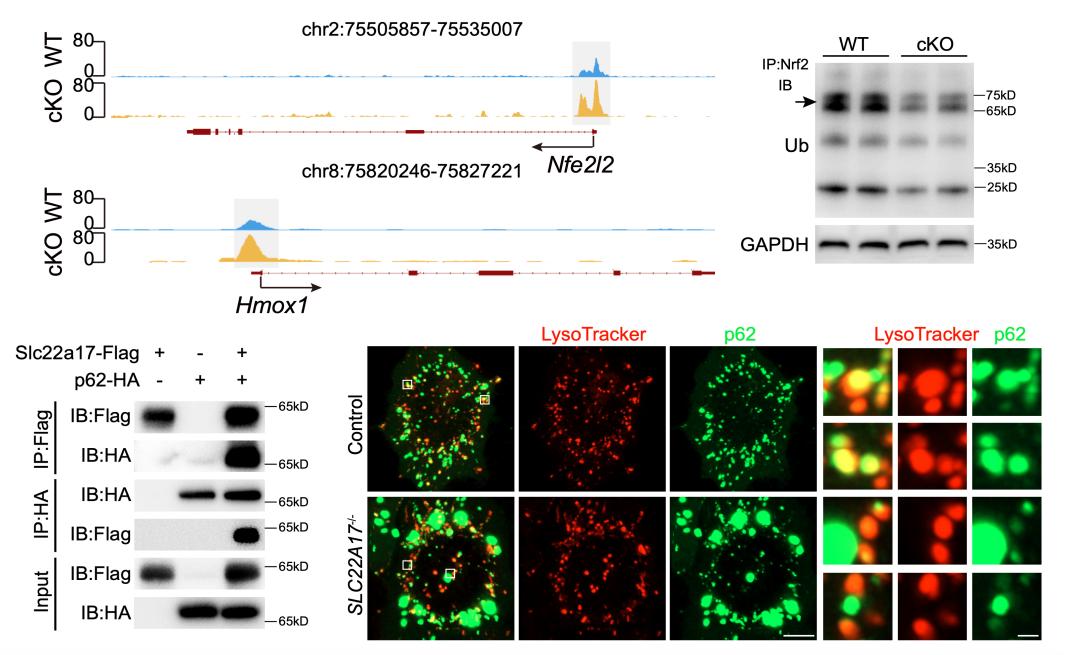
圖2 Slc22a17缺失激活Nrf2/HO-1信號通路
另一方面,RNA-seq和ATAC-seq的多組學(xué)分析結(jié)果顯示,Slc22a17缺失顯著激活調(diào)控氧化應(yīng)激反應(yīng)的核心信號通路——Nrf2/HO-1通路。機(jī)制研究進(jìn)一步表明,Slc22a17能夠與自噬銜接蛋白p62相互作用,其缺失導(dǎo)致p62在細(xì)胞內(nèi)累積,進(jìn)而結(jié)合Keap1,解除對Nrf2的抑制,使Nrf2轉(zhuǎn)入細(xì)胞核并啟動Hmox1基因轉(zhuǎn)錄。功能驗證實驗顯示,通過Nrf2基因敲除或使用HO-1競爭性抑制劑,可以有效緩解Slc22a17缺失所引起的神經(jīng)干細(xì)胞增殖與分化障礙,以及成年小鼠的海馬依賴性空間記憶缺陷。
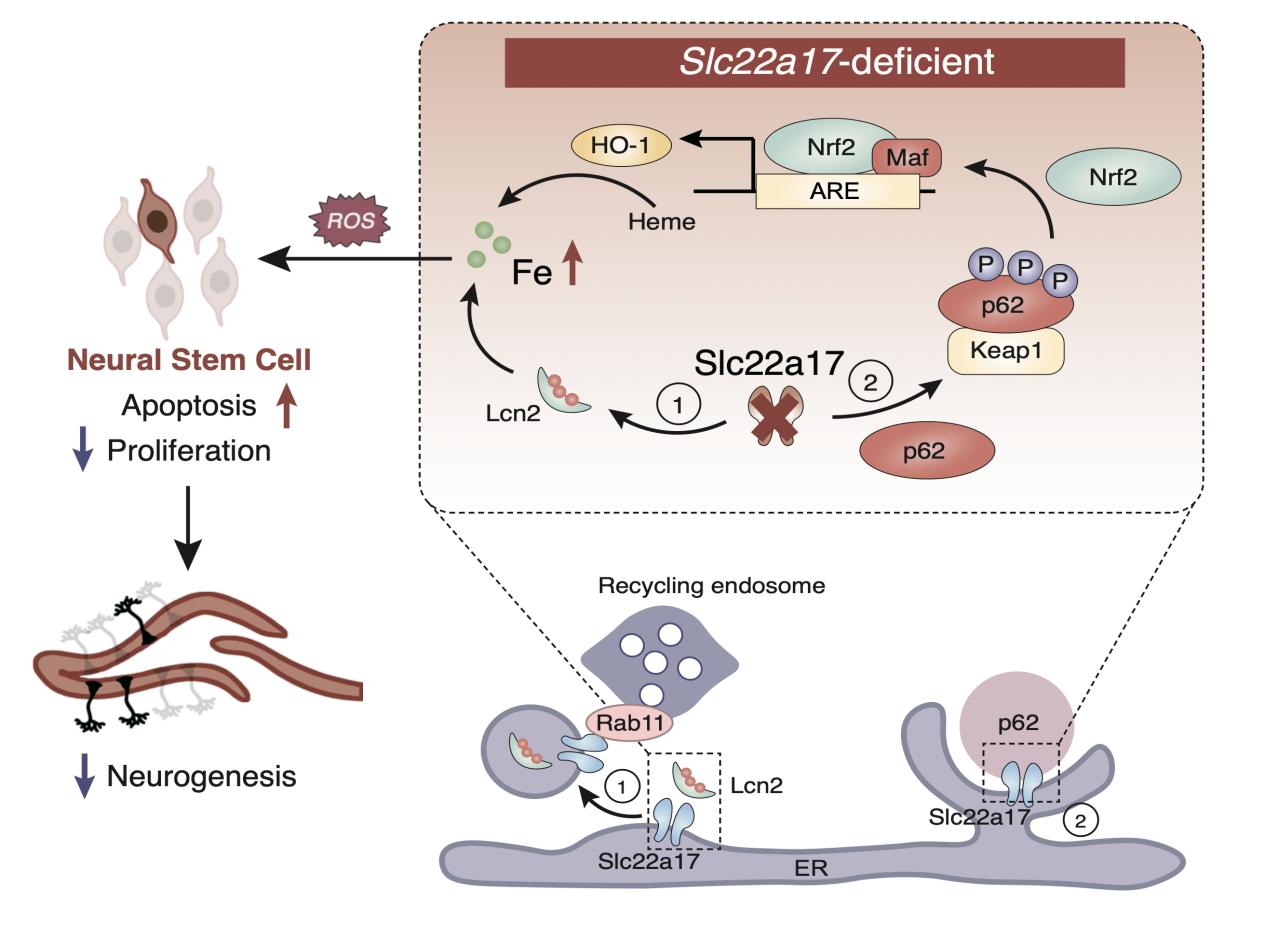
圖3 Slc22a17調(diào)控鐵代謝和神經(jīng)發(fā)生的機(jī)制圖
綜上所述,Slc22a17缺失導(dǎo)致神經(jīng)干細(xì)胞內(nèi)鐵異常積累,活性氧過量,引發(fā)細(xì)胞凋亡,從而嚴(yán)重抑制神經(jīng)發(fā)生并引起早期死亡。機(jī)制上,Slc22a17通過與p62相互作用調(diào)控Nrf2/HO-1信號通路,其缺失進(jìn)一步加劇鐵相關(guān)氧化應(yīng)激。此外該研究還發(fā)現(xiàn),Slc22a17主要定位于內(nèi)質(zhì)網(wǎng),可能作為上游鐵調(diào)控樞紐,通過回收內(nèi)體途徑促進(jìn)鐵的外排。本研究揭示了Slc22a17作為海馬鐵傳感器和轉(zhuǎn)運關(guān)鍵分子的獨特作用,闡明了鐵穩(wěn)態(tài)、氧化應(yīng)激與神經(jīng)發(fā)生之間的緊密聯(lián)系,為鐵代謝相關(guān)神經(jīng)發(fā)育障礙及認(rèn)知記憶功能障礙的治療提供了新的潛在靶點和治療方向。
清華大學(xué)藥學(xué)院陳立功教授為本文通訊作者,清華大學(xué)藥學(xué)院已畢業(yè)博士陶蕾、藥學(xué)院博士生滕龍、已畢業(yè)博士葛夢夢以及博士生王亞棋為該論文共同第一作者。軍事醫(yī)學(xué)研究院腦科學(xué)中心袁增強(qiáng)教授,清華大學(xué)生命學(xué)院米達(dá)副教授,基礎(chǔ)醫(yī)學(xué)院賈怡昌教授,藥學(xué)院秦為課題組為本項目的順利開展提供了重要建議和技術(shù)支持。該研究得到了國家自然科學(xué)基金委重點項目、科技部國家重點研發(fā)計劃,膜生物學(xué)全國重點實驗室等項目資助。
原文鏈接:https://www.nature.com/articles/s41467-025-66108-w

