G蛋白偶聯(lián)受體(GPCRs)是人體基因組中成員最多的膜蛋白受體超家族,也是藥物研發(fā)中最關(guān)鍵的靶點(diǎn)之一。這些受體遍布各類細(xì)胞表面,感知多種胞外信號(hào),并啟動(dòng)復(fù)雜的下游信號(hào)級(jí)聯(lián)反應(yīng)。GPCR激活后主要招募下游兩類信號(hào)轉(zhuǎn)導(dǎo)蛋白:G蛋白與β-arrestin蛋白。前期研究表明這二者結(jié)合于受體胞內(nèi)同一區(qū)域,呈現(xiàn)競(jìng)爭(zhēng)關(guān)系,并分別介導(dǎo)不同的生理效應(yīng)。β-arrestin的結(jié)合不僅會(huì)阻斷G蛋白信號(hào)傳導(dǎo),還會(huì)誘導(dǎo)受體內(nèi)吞。在一些情況下,兩條通路均被激活可能導(dǎo)致“在靶”副作用。典型例子包括阿片類鎮(zhèn)痛藥物(如嗎啡):其鎮(zhèn)痛效果依賴于G蛋白通路,而β-arrestin通路則可能引發(fā)藥物耐受等問題。為了解決“在靶”副作用問題,科學(xué)家們嘗試開發(fā)“偏向激動(dòng)劑”,即選擇性激活其中一條信號(hào)通路而非另一條的激動(dòng)劑。這一研究思路建立在G蛋白與β-arrestin 信號(hào)通路的“非此即彼”的競(jìng)爭(zhēng)關(guān)系之上。研究者們一直在探索是否存在GPCR活性調(diào)節(jié)的新模式,以推動(dòng)下一代GPCR藥物的開發(fā)。
2026年1月27日,清華大學(xué)藥學(xué)院、北京生物結(jié)構(gòu)研究中心及清華-北大生命科學(xué)聯(lián)合中心劉翔宇課題組在《細(xì)胞》(Cell)在線發(fā)表重要研究成果,題為《通用型別構(gòu)激動(dòng)劑穩(wěn)定的GPCR-G蛋白-β-arrestin超級(jí)復(fù)合物》(A GPCR-G protein-β-arrestin megacomplex enabled by a versatile allosteric modulator)。該研究通過自主建立的新型GPCR藥物篩選平臺(tái)(SPS方法),首次發(fā)現(xiàn)艾滋病臨床藥物阿扎那韋是一種可作用于多種GPCR的通用型正向別構(gòu)調(diào)節(jié)劑(pan-positive allosteric modulator,pan-PAM),并能介導(dǎo)G蛋白信號(hào)的持續(xù)激活。冷凍電鏡結(jié)構(gòu)進(jìn)一步表明,阿扎那韋如同“分子膠水”,促成GPCR、G蛋白與β-arrestin三者形成超級(jí)復(fù)合物,使原本對(duì)立的G蛋白與β-arrestin信號(hào)通路實(shí)現(xiàn)“化敵為友”的共存。這項(xiàng)工作拓展了對(duì)GPCR信號(hào)調(diào)控的理解,為創(chuàng)新藥物開發(fā)提供了全新視角。
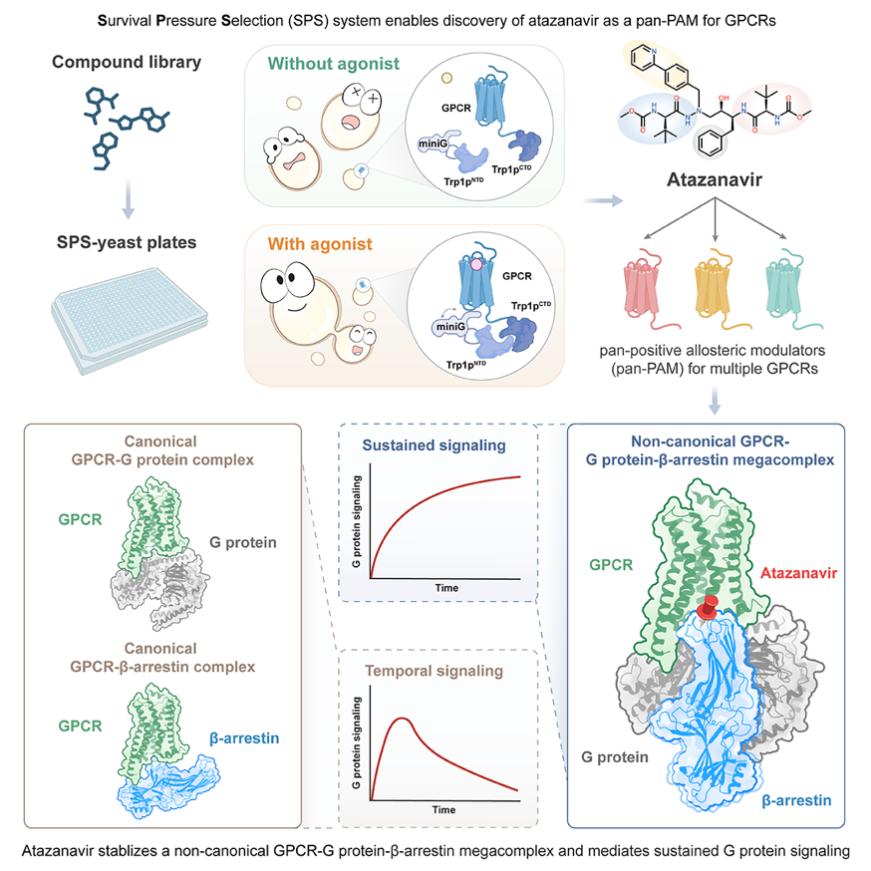
開發(fā)基于酵母生存壓力的SPS系統(tǒng)
研究團(tuán)隊(duì)首先在釀酒酵母中構(gòu)建了一種新型GPCR激動(dòng)劑篩選系統(tǒng)。他們基于GPCR與G蛋白間的相互作用方式,將酵母色氨酸合成關(guān)鍵酶Trp1p拆分為兩段,分別融合至GPCR和miniG蛋白。在GPCR未被激活的狀態(tài)下,酵母因無(wú)法組裝完整Trp1p而不能合成色氨酸,生長(zhǎng)嚴(yán)重受限;一旦GPCR被激活,miniG被招募至受體附近,促使Trp1p組裝完整,恢復(fù)色氨酸合成并加速生長(zhǎng)。因此,通過監(jiān)測(cè)酵母生長(zhǎng)速率即可判斷GPCR是否被激活。因?yàn)樵撓到y(tǒng)利用生長(zhǎng)壓力開展GPCR激動(dòng)劑篩選,故而被命名為“生存壓力選擇系統(tǒng)”(Survival Pressure Selection, SPS,圖1)。

圖1:SPS 方法設(shè)計(jì)示意圖
用SPS方法發(fā)現(xiàn)阿扎那韋為多個(gè)GPCR的通用型正向別構(gòu)調(diào)節(jié)劑
利用SPS方法,研究人員對(duì)二型糖尿病潛在靶點(diǎn)GPR119進(jìn)行了激動(dòng)劑篩選,鑒定出阿扎那韋為其新型激動(dòng)劑。冷凍電鏡結(jié)構(gòu)顯示,阿扎那韋作為別構(gòu)調(diào)節(jié)物結(jié)合于受體第六和第七個(gè)跨膜螺旋(TM6/7)的附近,并識(shí)別TM6的外擺構(gòu)象。該構(gòu)象變化是不同GPCR家族蛋白激活的共同特征。序列比對(duì)進(jìn)一步表明,該結(jié)合口袋在GPCR中較為保守,提示阿扎那韋可能具有廣譜活性。后續(xù)實(shí)驗(yàn)驗(yàn)證,它能廣泛激活包括腎上腺素受體、阿片類受體和毒蕈堿乙酰膽堿受體在內(nèi)的多種GPCR,并與正構(gòu)激動(dòng)劑產(chǎn)生協(xié)同作用,因此被稱為通用型正向別構(gòu)調(diào)節(jié)劑 pan-PAM。研究人員還解析了阿扎那韋結(jié)合β1腎上腺素受體與Gs蛋白復(fù)合物的冷凍電鏡結(jié)構(gòu),確認(rèn)其結(jié)合位點(diǎn)與GPR119中一致。
阿扎那韋誘導(dǎo)GPCR-G蛋白- β-arrestin超級(jí)復(fù)合物的形成并介導(dǎo)受體持續(xù)激活
深入藥理學(xué)研究發(fā)現(xiàn),阿扎那韋激活的G蛋白信號(hào)可持續(xù)增強(qiáng)超過60分鐘,顯著區(qū)別于傳統(tǒng)激動(dòng)劑的瞬時(shí)響應(yīng)。最初研究團(tuán)隊(duì)?wèi)岩砂⒃琼f可能具有G蛋白偏向性:不招募β-arrestin蛋白,從而避免β-arrestin介導(dǎo)的G蛋白信號(hào)終止。但是實(shí)驗(yàn)結(jié)果明確表明該化合物同樣高效介導(dǎo)β-arrestin的招募。這表明在阿扎那韋存在的情況下,受體招募β-arrestin的同時(shí)還可以持續(xù)激活G蛋白,提示這兩類信號(hào)傳導(dǎo)蛋白可能同時(shí)結(jié)合于受體附近,這明顯不同于傳統(tǒng)競(jìng)爭(zhēng)模型。
此前,杜克大學(xué) Robert J. Lefkowitz 教授團(tuán)隊(duì)在 2016 年和 2019 年的研究中首次報(bào)道了 GPCR-G 蛋白-β-arrestin 三元超級(jí)復(fù)合物(megacomplex)的存在。他們發(fā)現(xiàn),B 類 GPCR(Class B GPCR)因其羧基端富含磷酸化位點(diǎn),能夠以高親和力通過“尾部結(jié)合”(Tail engagement)方式穩(wěn)定捕獲 β-arrestin。在這種結(jié)合模式下,β-arrestin 與 G 蛋白分別占據(jù)受體的不同區(qū)域,從而實(shí)現(xiàn)二者共存,并支持 G 蛋白信號(hào)的持續(xù)激活。然而這一機(jī)制高度依賴于 B 類 GPCR 的羧基端豐富的磷酸化位點(diǎn)。而本研究涉及的所有靶點(diǎn)(包括β1腎上腺素受體、阿片受體等)均屬于A類 GPCR,缺乏對(duì) β-arrestin 的高親和力,理論上無(wú)法以類似機(jī)制形成超級(jí)復(fù)合物。那么,是否阿扎那韋具有特殊藥理性質(zhì),能夠在A類GPCR中也介導(dǎo)超級(jí)復(fù)合物的形成呢?研究人員通過一系列共定位實(shí)驗(yàn)發(fā)現(xiàn),阿扎那韋確實(shí)能夠以某種未知的方式促進(jìn)β-arrestin和 G 蛋白同時(shí)結(jié)合在受體附近。這種作用方式既不干擾 G 蛋白的結(jié)合,又能阻止信號(hào)脫敏,從而實(shí)現(xiàn)G蛋白通路的持續(xù)激活。
冷凍電鏡結(jié)構(gòu)揭示阿扎那韋以分子膠模式介導(dǎo)超級(jí)復(fù)合物的組裝
為了闡明阿扎那韋如何實(shí)現(xiàn)G蛋白與β-arrestin在A類GPCR上的共存,研究團(tuán)隊(duì)嘗試解析GPCR–G protein–β-arrestin超級(jí)復(fù)合物的高分辨率結(jié)構(gòu)。然而,這一任務(wù)面臨多重挑戰(zhàn):首先,β-arrestin與GPCR之間的親和力很低,二者結(jié)合短暫且不穩(wěn)定;其次,該復(fù)合物具有高度的動(dòng)態(tài)性和異質(zhì)性,極大增加了冷凍電鏡三維重構(gòu)的難度。面對(duì)這些困難,研究人員系統(tǒng)優(yōu)化了蛋白表達(dá)體系、復(fù)合物組裝條件及樣品制備流程,并嘗試多種先進(jìn)的數(shù)據(jù)處理策略,最終成功獲得了分辨率達(dá)3.2 ?的高質(zhì)量冷凍電鏡結(jié)構(gòu)。
該結(jié)構(gòu)首次清晰地揭示了阿扎那韋介導(dǎo)的三元復(fù)合物組裝方式。結(jié)果顯示,G蛋白依然占據(jù)受體胞內(nèi)側(cè)的經(jīng)典結(jié)合口袋。而β-arrestin則是通過阿扎那韋的錨定作用,以一種前所未見的“單擺構(gòu)象”(pendulum conformation)直接結(jié)合在受體第六與第七跨膜螺旋(TM6/7)的附近。在這種構(gòu)象下,β-arrestin的核心結(jié)構(gòu)域貼近受體近膜端,但其朝向和接觸面與B類GPCR中觀察到的“尾部結(jié)合”模式截然不同,也不同于任何已報(bào)道的GPCR–β-arrestin相互作用形式。阿扎那韋以“分子膠水”的方式結(jié)合在GPCR和β-arrestin共同組成的口袋里面,促進(jìn)了二者的直接結(jié)合。
綜上所述,本研究通過自主研發(fā)的“生存壓力篩選系統(tǒng)”(SPS)高通量篩選平臺(tái),成功實(shí)現(xiàn)“老藥新用”, 從已上市的臨床藥物庫(kù)中挖掘出抗艾滋病藥物阿扎那韋作為GPCR通用型正向別構(gòu)調(diào)節(jié)劑(pan-PAM)。該分子通過穩(wěn)定GPCR-G蛋白-β-arrestin超級(jí)復(fù)合物,實(shí)現(xiàn)G蛋白信號(hào)的持續(xù)激活。這一工作不僅為理解GPCR信號(hào)轉(zhuǎn)導(dǎo)的復(fù)雜性提供了全新的視角,更提出了一條超越“偏向激動(dòng)劑”策略的藥物設(shè)計(jì)新思路。傳統(tǒng)觀點(diǎn)將GPCR下游的G蛋白和β-arrestin蛋白視為競(jìng)爭(zhēng)關(guān)系,如同拔河比賽的雙方。在這個(gè)理念下,平衡激動(dòng)劑(Balanced Agonist)讓雙方勢(shì)均力敵,而偏向激動(dòng)劑(Biased Agonist)則讓其中一方占據(jù)上風(fēng),不過本質(zhì)上這兩條信號(hào)通路還是彼此對(duì)抗的狀態(tài)。與之不同,本研究揭示了一種全新的非競(jìng)爭(zhēng)模式,其中G蛋白和β-arrestin蛋白“化敵為友”,攜手調(diào)控下游信號(hào)。研究者們將其命名為橋接信號(hào)轉(zhuǎn)導(dǎo)(Bridged Signaling)(圖2)。在后續(xù)研究中,基于阿扎那韋的分子骨架進(jìn)行結(jié)構(gòu)優(yōu)化,有望催生一類具有持續(xù)信號(hào)輸出和低耐受性的GPCR靶向藥物。
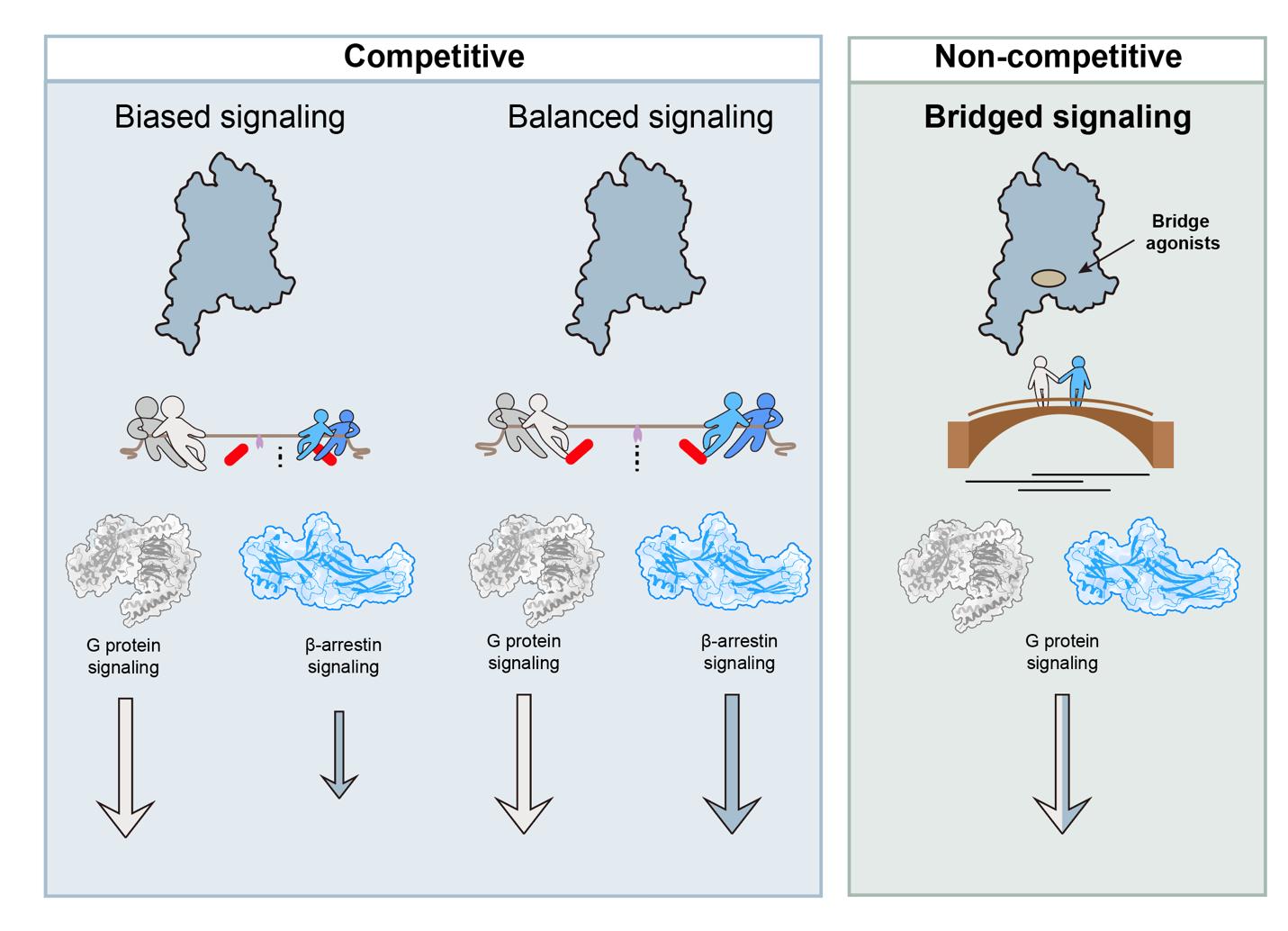
圖2:橋接信號(hào)轉(zhuǎn)導(dǎo)模式圖
清華大學(xué)藥學(xué)院劉翔宇副教授課題組博士后何國(guó)棟博士,博士生孫沁心,已出站博士后許心宇博士(現(xiàn)為加州大學(xué)舊金山分校博士后)為本研究的第一作者。許心宇博士和劉翔宇副教授為本研究的通訊作者。劉翔宇課題組原成員張書豪博士(現(xiàn)為斯坦福大學(xué)博士后)和孫曉鷗博士為研究做出了重要貢獻(xiàn)。清華大學(xué)生命科學(xué)學(xué)院閆創(chuàng)業(yè)副教授和孔方博士(現(xiàn)為西湖大學(xué)博士后)為冷凍電鏡數(shù)據(jù)處理提供了重要建議和幫助。沈陽(yáng)藥科大學(xué)無(wú)涯創(chuàng)新學(xué)院林斌副教授在分子動(dòng)力學(xué)模擬方面提供了重要幫助。常州大學(xué)藥學(xué)院陳新教授和碩士生葉苛欣在小分子合成方面提供了重要幫助。本研究得到了國(guó)家自然科學(xué)基金委,北京市生物結(jié)構(gòu)前沿研究中心,清華大學(xué)-北京大學(xué)生命科學(xué)聯(lián)合中心以及清華大學(xué)篤實(shí)專項(xiàng)的資助。國(guó)家蛋白質(zhì)科學(xué)中心(北京)清華大學(xué)分中心冷凍電鏡平臺(tái)、蛋白質(zhì)化學(xué)與組學(xué)平臺(tái),清華大學(xué)藥學(xué)技術(shù)中心,北京水木未來(lái)生物科技公司為本研究提供了重要技術(shù)支持。斯坦福大學(xué)Brian Kobilka教授以及清華大學(xué)基礎(chǔ)醫(yī)學(xué)院已出站博士后衡杰博士(現(xiàn)為百濟(jì)神州科學(xué)家)為本工作提供了重要建議,本研究使用的 NanoBiT系統(tǒng)相關(guān)質(zhì)粒由日本京都大學(xué)/東北大學(xué) Asuka Inoue教授饋贈(zèng)。
完整論文鏈接:https://www.cell.com/cell/fulltext/S0092-8674(25)01436-9?sessionid=

