1. “藥物-材料-水”的分子間相互作用對制劑結(jié)構(gòu)和行為的影響:
作為一個熱力學(xué)不穩(wěn)定體系,無定形藥物-高分子固體分散體(amorphous solid dispersion, ASD)的物理穩(wěn)定性是這一制劑的主要風(fēng)險之一。 我們提出了設(shè)計ASD的工作路線圖,以降低ASD的穩(wěn)定性風(fēng)險。這一思路被業(yè)內(nèi)同行廣泛認(rèn)可。 此外,我們提出“藥物-材料-水”的分子間相互作用是決定ASD藥學(xué)表現(xiàn)的核心影響因素,并且建立了表征“藥物-材料-水”三者相互作用的方法學(xué)。我們還通過體內(nèi)外實驗明確證明了藥物-材料的相互作用對藥物制劑的溶出,生物利用度的影響。以上這些工作對難溶藥物的制劑設(shè)計和優(yōu)化具備重要應(yīng)用意義。
2. 針對KRAS突變的癌癥細(xì)胞的藥物遞送策略:
KRAS突變被認(rèn)為很難以進(jìn)行靶向藥物設(shè)計。我們提出了一種靶向KRAS突變癌癥細(xì)胞的藥物遞送策略。這一策略的提出是基于KRAS突變癌癥細(xì)胞不同于KRAS野生型正常細(xì)胞的生物學(xué)特點,即,增強的巨胞飲和低表達(dá)的FcRn受體。在藥物遞送領(lǐng)域內(nèi),利用疾病生物學(xué)機制,靶向特定基因型細(xì)胞的藥物遞送是一個全新的嘗試。
3. 高濃度蛋白的聚集動力學(xué)和溶液穩(wěn)定性機制:
皮下和局部注射蛋白藥物,常常需要很高濃度的蛋白溶液制劑。在高濃度下,蛋白分子相互作用變得更為復(fù)雜,對蛋白的結(jié)構(gòu)和膠體穩(wěn)定性都可帶來負(fù)面影響,并加速不可逆的蛋白聚集,導(dǎo)致藥效降低、產(chǎn)品表觀質(zhì)量下降、病人過敏反應(yīng)而降低用藥的安全性。高濃度蛋白溶液的設(shè)計和風(fēng)險評價一般都是以試錯方式進(jìn)行的。我們嘗試從物理化學(xué)、膠體科學(xué)層面探究影響蛋白溶液相分離和聚集的關(guān)鍵因素和動力學(xué)過程,為高濃度蛋白制劑設(shè)計提供理論依據(jù)。
研究成果
1. “藥物-材料-水”的分子間相互作用對制劑藥劑學(xué)行為的影響:
我們在2015年提出了研究“藥物-材料-水”的方法學(xué),“χASD-water plot”(ASD和水的Flory-Huggins相互作用參數(shù)相對于ASD的載藥量的變化, 圖1),我們發(fā)現(xiàn)這一表征手段可以清晰揭示ASD中藥物和高分子的相互作用強度、種類、以及在水作用下的變化,并且發(fā)現(xiàn)這些分子間相互作用和ASD的溶出密切相關(guān)。 當(dāng)藥物-高分子相互作用使得體系更為疏水,且這一相互作用不為水所破壞時,ASD表現(xiàn)出最佳溶出效果。這一工作首次確認(rèn)了分子間相互作用和制劑溶出行為的關(guān)聯(lián)。隨后,我們在多個研究中驗證了藥物和材料之間的分子間相互作用,對制劑結(jié)構(gòu)和表現(xiàn)的影響,這樣的分子藥劑學(xué)的研究思路也支持了多個新藥的制劑研發(fā)。(Mol. Pharmaceutic, 2016, 13, 599–608; Mol. Pharmaceutic, 2016, 13, 2787-2795;Pharm Res, 2016, 33(10), 2445-2458;Cryst. Growth Des., 2016, 16, 5367-5376;Mol. Pharmaceutics, 2018, 15 (7), 2754–2763;Mol. Pharmaceutics, 2019, 16(1), pp 318–326; ACS Infect. Dis. 2020, 6, 5, 802–810;etc.)
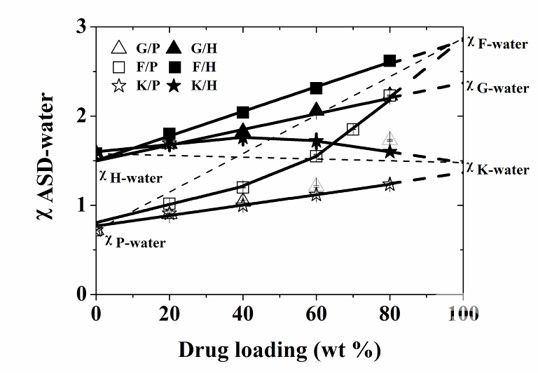
圖1. 六種ASD體系(G, F, K 為三種模型藥物,P, H 分別為PVP-VA和HPMC-AS兩種高子)的χASD-water和ASD載藥量的關(guān)系。 這一圖示預(yù)測了不同ASD的溶出表現(xiàn),從而為ASD制劑的設(shè)計提供了清晰的理論指導(dǎo)。(Molecular Pharmaceutics, 2015,12(2):576-89.)
2. 針對KRAS突變癌癥的藥物遞送:
雖然藥物化學(xué)家在設(shè)計靶向KRAS抑制劑方面已經(jīng)取得了不少進(jìn)展, 突變的KRAS(特別是G12D,G12V,等)仍然被認(rèn)為是難以成藥的靶點。我們提出了一種針對KRAS突變癌癥細(xì)胞的藥物遞送策略。基于KRAS突變細(xì)胞增強的巨胞飲,和FcRn受體低表達(dá)的生物學(xué)特征, 我們發(fā)現(xiàn),白蛋白偶聯(lián)的藥物,在維持白蛋白天然結(jié)構(gòu)的情況下,將顯著依賴巨胞飲方式進(jìn)入KRAS突變的癌細(xì)胞,入胞后通過溶酶體降解路徑,在缺少FcRn結(jié)合保護(hù)的情況下有效釋放出藥物載荷;與KRAS突變的胰腺癌細(xì)胞形成鮮明對比的是,KRAS野生型的正常上皮細(xì)胞以網(wǎng)格蛋白介導(dǎo)內(nèi)吞的方式攝取白蛋白偶聯(lián)藥物,入胞后由于其與FcRn受體的緊密結(jié)合被迅速分選至循環(huán)小泡,繼而被胞吐出胞。我們發(fā)現(xiàn),受益于這種在不同KRAS基因型下內(nèi)吞轉(zhuǎn)運表型的差異,白蛋白偶聯(lián)藥物可以顯著提高(~10倍)藥物載荷的治療窗口。白蛋白偶聯(lián)藥物這一策略提供了一種利用藥物遞送手段獲得KRAS細(xì)胞靶向的可能(圖2)。我們同時探索了其他具備KRAS靶向特點的藥物遞送系統(tǒng),以及針對KRAS突變胰腺癌腫瘤微環(huán)境的藥物遞送系統(tǒng),并基于相關(guān)的發(fā)現(xiàn),探索開發(fā)一系列針對KRAS突變腫瘤,特別是胰腺癌,的新型藥物遞送策略 (Cancer Letters, 2022,539, 215718;Theranostics. 2022; 12(3): 1061-1073;J Control Release. 2020;323(March):311-320;Advanced Therapeutics. 2019, 1900032, ACS Nano, 2019 23;13(4):4049-4063; Small, 2018 Dec;14(51):e1802112,etc.)
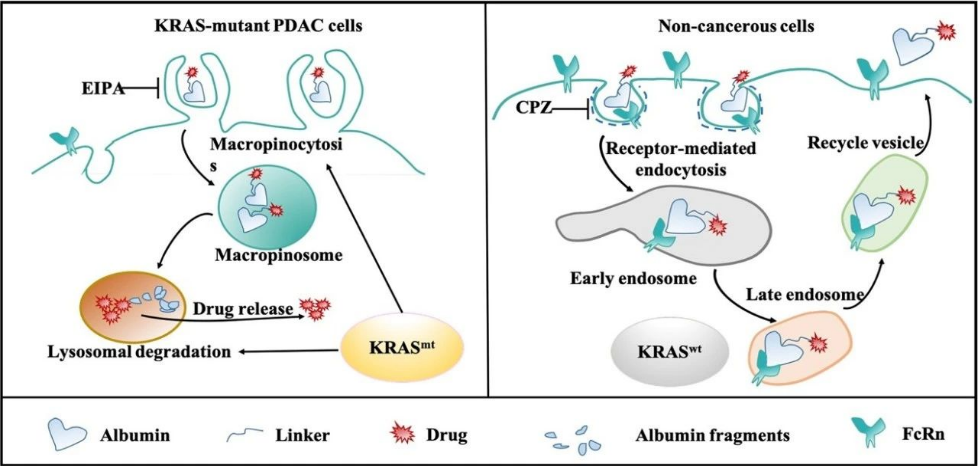
圖2. 白蛋白藥物偶聯(lián)物的細(xì)胞內(nèi)吞轉(zhuǎn)運機制示意圖 。(J Control Release.2019;296(January):40-53.)
3. 高濃度蛋白的聚集動力學(xué)和溶液穩(wěn)定性機制
以單抗(Monoclonal Antibody, mAb)為代表的蛋白藥物是當(dāng)今發(fā)展最為迅速的一類生物大分子藥物,具有靶向性強、副作用小等優(yōu)勢。由于單抗的高劑量和皮下及局部(比如,玻璃體內(nèi))注射小體積需求,其制劑常常是高濃度膠體溶液,使得單抗分子在制劑中的相互作用變得更為復(fù)雜,對單抗的結(jié)構(gòu)和膠體穩(wěn)定性都可帶來負(fù)面影響,并加速不可逆的單抗聚集,導(dǎo)致藥效降低、產(chǎn)品表觀質(zhì)量下降、病人過敏反應(yīng)而降低用藥的安全性。我們致力研究單抗聚集動力學(xué)基礎(chǔ)和穩(wěn)定性機制,并探索開發(fā)新型高濃度蛋白藥物制劑用于皮下和局部(比如玻璃體內(nèi)注射)。我們從物理化學(xué)、膠體科學(xué)層面深度探究了影響單抗溶液相分離和聚集的關(guān)鍵結(jié)構(gòu)因子和溶液理化因素。發(fā)現(xiàn)單抗分子在相分離過程中以一級動力學(xué)規(guī)律聚集成核且不斷長大并形成高濃度的單抗液滴,最終沉降形成明顯的相分離狀態(tài)。本研究從單抗聚集動力學(xué)角度定義了可量化的關(guān)鍵動力學(xué)參數(shù),如成核速率,生長速率以及核生長起始時,用于評估溶液中單抗聚集速率及制劑條件的優(yōu)劣(圖3)。
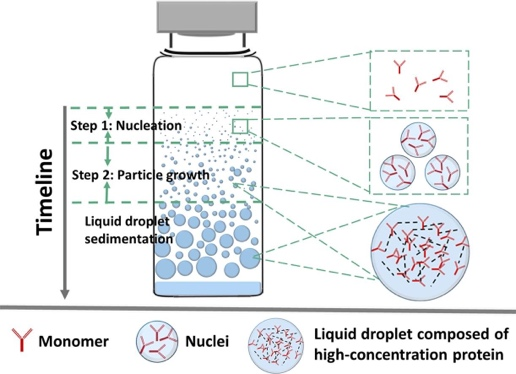
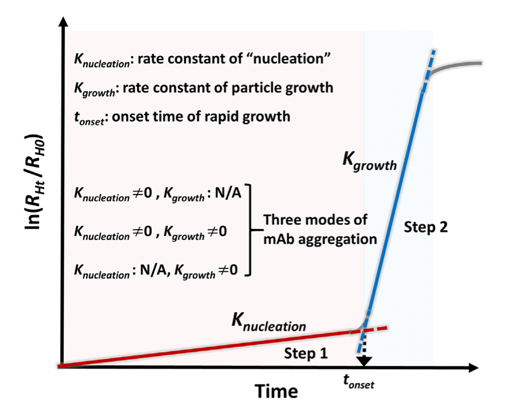
圖3. 單抗溶液發(fā)生相分離的動力學(xué)過程——成核與生長(International Journal of Pharmaceutics, 2020, 588, 119681.)
我們還對蛋白-蛋白相互作用,蛋白-輔料相互作用的模式進(jìn)行了深入探討,發(fā)現(xiàn)蛋白溶液制劑中的微小輔料改變,有可能顯著改變?nèi)芤褐苿┲械鞍字g的相互作用方式和強度,從而誘導(dǎo)液-液相分離等一系列蛋白溶液制劑穩(wěn)定性風(fēng)險(Molecular Pharmaceutics, 2021, 18, 1, 267–274)。這些發(fā)現(xiàn)為高濃度蛋白制劑的研發(fā)提供了很好的理論基礎(chǔ)。
榮譽和獎項
清華大學(xué)-楊森研究員(Janssen-Tsinghua Investigator)
“Chemistry Leadership Award”, 百時美-施貴寶制藥公司 (Bristol-Myers Squibb Company), 2008
代表性論文
1. Dou L, Liu H., Wang K, Liu J, Liu L, Ye J, Wang R, Deng H, Qian F.*; Albumin binding revitalizes NQO1 bioactivatable drugs as novel therapeutics for pancreatic cancer, Journal of Controlled Release, 2022 Aug 4;349:876-889. doi: 10.1016/j.jconrel.2022.07.033.
2. Kong W, Liu Z, Sun M, Liu H, Kong C, Ma J, Wang R, Qian F.*; Synergistic Autophagy Blockade and VDR Signaling Activation Enhance Stellate Cell Reprogramming in Pancreatic Ductal Adenocarcinoma, Cancer Letters. 2022 Jul 28;539:215718. doi: 10.1016/j.canlet.2022.215718. Epub 2022 May 5.
3. Fang Yuan, Mengnan Sun, Zhengsheng Liu, Huiqin Liu, Weijian Kong, Rui Wang, Qian F*, Macropinocytic dextran facilitates KRAS-targeted delivery while reducing drug-induced tumor immunity depletion in pancreatic cancer. Theranostics. 2022; 12(3): 1061-1073. doi: 10.7150/thno.65299
4. Liu H; Yu S; Qian F*, Opportunities and delusions regarding drug delivery targeting pancreatic cancer-associated fibroblasts, Advanced Drug Delivery Reviews, 2021 May;172:37-51. https://doi.org/10.1016/j.addr.2021.02.012
5. Zhou T,; Qian F.*; Adenosine Triphosphate-Induced Rapid Liquid–Liquid Phase Separation of a Model IgG1 mAb, Mol. Pharmaceutics. 2021 18 (1), 267-274, DOI: 10.1021/acs.molpharmaceut.0c00905
6. Mi W; Chen H; Zhu A, Zhang T, Qian F*, Melting point prediction of organic molecules by deciphering the chemical structure into a natural language, Chemical Communications, 2021, 57, 2633 – 2636
7. Yuan F; Sun M; Liu H; Qian, F.*, Albumin-conjugated drug is irresistible by single gene mutation of endocytic system: verification by genome-wide CRISPR-Cas9 loss-of function screens, Journal of Controlled Release, Vol 323, 10 July 2020, Pages 311-320
8. Hu C.; Liu Z.; Liu C.; Zhang Y.; Fan H.; Qian F.*; Improvement of Antialveolar Echinococcosis Efficacy of Albendazole by a Novel Nanocrystalline Formulation with Enhanced Oral Bioavailability, ACS Infect. Dis. 2020, 6, 5, 802–810
9. Kong C; Li Y; Liu Z; Ye J; Wang Z; Zhang L; Kong W.; Liu H.; Liu C.; Pang H.; Hu Z.; Gao J.; and Qian, F*, Targeting the Oncogene KRAS Mutant Pancreatic Cancer by Synergistic Blocking of Lysosomal Acidification and Rapid Drug Release, ACS Nano, DOI: 10.1021/acsnano.8b08246, March 26, 2019.
10. Liu H; Sun M; Liu Z; Kong C; Kong W; Ye J; Gong J; Huang D; Qian, F.*, KRAS-enhanced macropinocytosis and reduced FcRn-mediated recycling sensitize pancreatic cancer to albumin-conjugated drugs, Journal of Controlled Release, Vol 296, 28 February 2019, Pages 40-53.

